ECCO2R的前世今生
ECCO2R的概念是应对ECMO的早期研究提出的,由于后者不良反应及机械并发症的高发生率,使得其治疗仅限于危重患者的最后一搏。ECMO高昂的费用及操作的复杂性,又使得其使用仅限于少数医学中心。随着对呼吸衰竭患者生命支持(包括机械通气及ECMO)的发展,认识到气体交换的有效部分可通过患者肺使用损伤较小的通气策略来达到;很多情况下,部分体外CO2气体交换较氧合更需要。
1977年,Kolobow和Gattinoni分别提出部分支持(仅清除CO2,对氧合无或仅轻度影响:部分体外支持)这一理念。他们建议只需要少的呼吸机呼吸次数、小潮气量及低吸气峰压,可以避免对肺的损伤。为降低体外肺支持的复杂性、费用及不良反应,Pesenti等改良了用于肾替代疗法的体外回路,在回路中增加了氧合器,并提出只是部分清除产生的CO2这一概念,这样允许肺损伤低的呼吸机设置。
(一)ECCO2R的原理
与提供有效氧合的装置ECMO不同,ECCO2R是清除CO2的装置。ECCO2R最简单的构成是一个输出管、一个泵、一个膜肺和一个输入管(图3-10)。含CO2的血液被泵出至膜肺中,CO2通过弥散作用被清除。膜肺的膜只能使气体通过而液体不能。膜肺的另一侧为含有少量或没有CO2的氧气流,以保证CO2的弥散梯度。
与ECMO的氧合需要很高的血流量不同,ECCO2R在较低的血流速度即可有效清除CO2。这与CO2与O2的溶解度及解离曲线相关。
影响气体交换的因素:气体交换面积(膜面积),交换膜的完整性,血红蛋白的携氧能力,气体的溶解度,气体弥散系数,膜两侧气体压差。
O2少部分溶解于血浆,0.3ml/100ml血,大部分通过血红蛋白携带。当所有血红蛋白都结合氧时,氧饱和度为100%,血氧分压在95~100mmHg,此时,即使肺泡氧分压再提高也不能增加血流的携氧量。要提高携氧能力,只能增加膜的面积及血流速度。因此,ECMO要达到有效的氧合,需要较大的膜面积及较高的血流量。
CO2可溶性很强,其溶解度是O2的24倍。CO2有5%~10%溶解于血中,大部分以碳酸氢盐形式存在。从二氧化碳解离曲线(图3-11)可见,血液中CO2含量随CO2分压上升而增加,几乎成线性关系,而不似氧解离曲线“S”形,也没有饱和点,当CO2分压不断上升,CO2含量也增加。所以其纵坐标不用饱和度而用浓度来表示。氧分压的增加对CO2释放有利,在二氧化碳解离曲线上有两条差不多的平行曲线(图3-11)。上一曲线为静脉血中CO2容积百分比,下一曲线为动脉血中CO2容积百分比,在同样CO2分压下,动脉血中CO2容积百分比较小,即在氧合血红蛋白影响下,CO2容易从碳酸氢根释放出来。
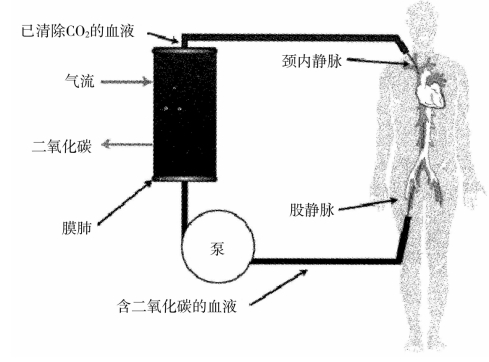
图3-10 体外二氧化碳清除环路基本构件示意图

图3-11 CO2解离曲线
A为静脉血;B为动脉血(1mmHg=0.133kPa)
使用含100%氧流,隔开血与气的膜两侧的O2、CO2分压阶差明显大于活体肺毛细血管与肺泡的压力阶差,这样有利于克服膜的弥散阻力。另外,CO2解离曲线的陡直部分正好在其生理范围(40~45mmHg)。加之大部分的CO2是以碳酸氢盐的形式溶于血液中,且呈直线的解离曲线而无饱和现象。1L血液中可溶解的CO2多于O2,250ml的CO2可以从小于1L的血液中清除;另外,CO2因有更好的溶解性而比氧气更容易通过膜肺弥散出来。因此,与ECMO的氧合比较,ECCO2R使用较低的血流速度及较小的膜面积即可达到有临床意义的CO2部分清除(一般为基础量的50%)。
(二)ECCO2R的构成
1.膜肺 膜肺使得长时间体外气体交换成为可能。在膜肺出现之前,体外循环通路使血液在旋转的桶或碟上形成薄层血膜来达到气血交换。然而,气血直接交互作用可使蛋白变性,活化凝血及炎症通路,损伤循环细胞。因此,基于气血直接交互的设备,使用不超过数小时,否则会出现严重并发症。
在血与气之间设置隔膜的概念,始于在血液透析机观察到通过赛璐酚(一种玻璃纸)管道存在气体交换。由此催生了膜肺的发展,它由蒙在尼龙网格上允许气体通透的硅橡胶组成。尼龙网格提供支撑力并减少了在薄硅橡胶膜的制作中产生的针孔样气孔所致的血浆渗漏。3个决定气体通过膜的因素,弥散梯度、膜-血接触时间、膜的弥散特性。
决定CO2弥散梯度的因素有血及气流中CO2的含量,以及气流速度。膜血接触时间由膜的几何形态来决定。在早期膜肺研究中,Theodore Kolobow将膜排列成螺旋状,并应用表面不规则的织物,这样增加膜面积。现今中空纤维膜已取代螺旋状硅橡胶膜。早期的纤维采用多微孔的聚丙烯纤维。微孔可发生显微镜下才能看到的气血交流,促进有效的气体交换,但也会引起血浆渗漏。最近无微孔的聚-4-甲基-1-戊烯(PMP)得到应用,它提供更有效的气体交换,更好的生物相容性,且不容易出现血浆渗漏。通过共价结合将肝素添加到膜表面,增进了生物相容性。将中空纤维排列成复杂的垫状,血流在纤维外流动接触膜,促进了气血交换。这种排列允许血流垂直流经纤维,与平行于纤维的血流相比,缩短了弥散路径的长度,促进转运。现代膜肺用1~3m2的表面积即可达到适宜的气体交换。
2.泵 血液流经ECCO2R回路通过以下两种方式达到。对于有一定动脉压的患者,可采用无泵回路,血借助高的动脉压从动脉通路引出,流经膜肺后再通过静脉通路回到体内,常称为动静脉CO2清除(AVCO2R)。无泵系统对血液损伤小,但需要大口径动脉通路及合适的心排血量。(https://www.daowen.com)
另一种方式是使用机械泵。早期设备使用的机械泵为滚轴或蠕动泵。尽管便宜且可靠,这类泵易损伤血液,如由于挤压及受热导致的溶血。当血流速度较低时血液损伤可能问题不大,如用于血液透析的泵。旋转泵的引入导致简单高效系统的出现,且血液损伤小。用于ECCO2R的旋转泵主要有两种,离心泵及对角线式血流泵。
离心泵采用径向旋转叶轮,形成抽吸涡流将血流引向泵的中心,并向外侧旋转,形成离心动能,转换为驱动压。
对角线式血流泵,其叶轮设计成径向和轴向的复合几何形结构。离心泵倾向于产生高压及低流速,而对角线式血流泵产生高流速兼高压。
叶轮连接驱动轴,需要轴承来支撑旋转运动。血液暴露于轴承促进血液凝固,导致凝血块的沉积,阻碍轴承运动。目前最先进的离心泵的叶轮完全悬浮于电磁场,不再需要驱动轴或轴承,减少产热,减轻血液损伤,降低机械故障率。
3.血管通路 早期研究的引流及回流通路分别置于双侧大隐静脉。现通过经皮穿刺置于股静脉-股静脉或股静脉-颈静脉通路。为维持血流及减少血液损伤,使用肝素涂层的钢丝增强的导管通路。最近出现了一种高流量、金属丝增强的双腔导管。在超声引导下将它置于右侧颈内静脉,引血端口(位于导管尖端)向前置于下腔静脉近肝内静脉处。按此方向,回血端口正好在右心房水平,减少了再循环。新的ECCO2R仪使用类似于血液透析的双腔导管,血流速度也相似。
(三)已用于临床的ECCO2R装置
第一个体外呼吸支持的临床试验发表于1979年,使用Kolobow的螺旋圈膜肺,滚筒泵及动-静脉通路来实现ECMO。该研究发现ECMO与常规治疗比较差异不大。几乎同时,Gattinoni和其同事介绍了ECCO2R,但直到1986年才发表该临床研究,对ARDS患者联合LPV和ECCO2R(Kolobow螺旋线圈膜肺、滚筒泵),死亡率为51%。后续研究令人鼓舞,但1994年的RCT研究表明,ECCO2R在生存率方面无优势,重要的是,ECCO2R的并发症发生率高,33%因出血停止治疗,20%出现管路凝血。最近,新的低并发症的装置的出现已显示出联合超保护性通气策略可改善预后。一些已进入市场,另一些研究进展不错。这些ECCO2R设备可分类为AVCO2R、VVCO2R。
1.AVCO2R Novalung公司(GmbH、Hechingen、Germany)的AVCO2R已面世,市面上称为介入肺辅助(iLA)膜呼吸器,常称为“Novalung”,应用低阻力的设计,使得应用动静脉压差即可形成血流。血管通路通过经皮放置于股动、静脉。
无泵系统需要动静脉压差≥60mmHg,因此,不适合血流动力不稳定的患者。另外,在大的动脉建立通路可致远端缺血,尽管有利用超声选择测量动脉内径,选择导管不超过动脉管腔70%能降低这一风险。AVCO2R已成功用于ARDS肺保护性通气患者,严重哮喘及作为肺移植的过渡。
2.VVCO2R 静脉-静脉CO2清除(VVCO2R)需要机械泵来推动血流经过体外循环回路,依泵是否与膜分开或结合为一体分类。当泵与膜分开用时,循环回路见图3-12。图3-12显示各个不同部件,这一回路操作起来比较复杂,常需要血流速度1L/min,这样可能需要多学科团队支持。随技术的进步,新一代的仪器将膜肺与泵结合在一块,血流速度相对低,这样使得操作更简单。

图3-12 DECAP示意图
(1)iLA Activve:iLA Activve将膜肺(Novalung)和对角线式血流泵合二为一,当用高血流时此仪器可当V-VECMO用。从概念上来讲,这是通过泵膜合一提供ECCO2R最简单的方法,尽管它比分开部件装置并不提供额外的益处,此泵能在较大流速范围内提供稳定的血流。
(2)Decap/Decapsmart:Decap系统(Hemodec、Salerno、Italy)将膜肺与透析滤器串联,并使用蠕动泵。此处用血透滤器有两个目的。第一通过增加膜肺内的阻力来减少气泡形成的机会;第二,超滤液回流到膜肺血流入口之前的血流中。因超滤液含有溶解的二氧化碳,如此再循环通过产生比患者血流更大的流速允许额外的二氧化碳清除。与常规ECCO2R相比,相应地可使用较小的膜肺(0.3~1.35m2)及较低的血流速度(<500ml/min),所需要抗凝血药与CRRT接近。Decap系统已成功地用于成人及儿童。
(3)Hemolung:Hemolung(Alung Technologies,Pettsburgh,USA)是三者中最后进入ECCO2R竞技场者。此设备中膜肺和离心泵整合成一个单元。血液通过旋转推进器吸进单元。单元中央有一个旋转核心,通过它将血液朝周边固定的纤维束加速。这称为主动拌和,旋转核心在纤维膜下产生扰动的血流模式,降低弥散阻力,促进气体交换。这样,使用比较小的膜面积及400~600ml/min的流速也可达到有效CO2的清除。允许使用较小的双腔导管血管通路。小的膜表面面积,硅氧烷涂层降低对血液阻力,共价结合的肝素导致低的抗凝需求。通过膜肺的气流采用负压提供,这一安全特征可防止膜破裂时的空气栓塞。
表3-2对各种体外支持技术做一比较。
表3-2 体外支持技术
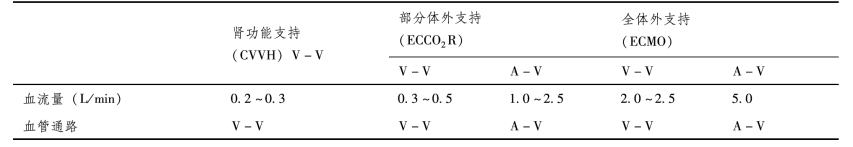
续 表