急性胃肠功能障碍的处理
针对以上问题,Reintam等人继续进行研究,并致力于推广胃肠功能障碍的评分系统,遂成立了欧洲危重病学会的腹部问题工作小组,针对目前重症患者的胃肠功能及胃肠功能障碍缺乏统一的定义与分级,并于2012年发布了最新的关于重症患者胃肠功能的推荐,包括相关的术语、定义和管理等方面;此外,首次明确提出AGI的概念,并推出了全新的AGI分级,分为4级。
(一)术语、定义和管理
重症患者常处于镇静状态,胃肠道不适常无法直接表达,故重症患者的胃肠道症状及治疗有其自己的特点。
1.食物不耐受综合征(feeding intolerance syndrome,FI) 食物不耐受综合征的诊断常基于复杂的临床评估,目前没有单独明确的症状或指标来定义FI。当经过72小时,20kcal/(kg·d)的能量供给目标不能由肠内营养途径实现,或者因任何临床原因停止肠内营养的,需考虑FI的可能性。FI常需要临床干预来维持或重建胃肠道功能:包括限制使用损害肠动力药物,应用促动力药物和(或)使用通便药物,控制腹腔内压。临床可以尝试给予少量的肠内营养。FI者应给予补充肠外营养。目前数据显示,延迟1周的肠外营养与早期肠外营养相比,可以促进病情恢复。
2.腹腔内高压 指临床上6小时内至少两次测量腹腔内压≥12mmHg。治疗上应当注意液体复苏策略,避免过度复苏。对于原发性腹腔内高压的术后患者,持续的胸椎硬膜外镇痛可以降低腹腔内压。建议使用鼻胃管/结肠减压方法,用于排出胃肠道的内容物。腹腔积液患者,推荐使用经皮管道引流减压。床头抬高超过20°是IAH发展的额外危险因素。肌松药可以降低腹腔内压,但由于其过多的不良反应,仅在特定的患者中使用。
3.腹腔间隔室综合征(abdominal compartment syndrome,ACS) 腹腔间隔室综合征是指腹腔内压持续增高,在6小时内至少两次腹腔内压测量均超过20mmHg,并出现新的器官功能障碍。治疗上,尽管外科减压是治疗ACS唯一确切的处理措施,但其适应证和手术时机的选择仍然存在争议。对于保守治疗无效的ACS患者,推荐外科减压作为抢救生命的重要措施。对于存在多个IAH/ACS危险因素患者,在进行剖腹手术时,可以给予预防性减压措施。在大多数严重的腹主动脉瘤破裂或腹部创伤患者,可以不关腹,使用人工膜覆盖,避免ACS进一步发展。
4.胃潴留 单次胃残留量>200ml,定义为大量胃潴留。暂没有足够的科学证据或生理学依据来定义大量胃潴留的确切值,也没有标准的测量胃残留方法。当胃残留>200ml时,需密切的床旁评估与监测;如果单次的胃残留量在200~500ml,不应停止输注肠内营养;若胃残留量>500ml,则应停止经胃营养,考虑幽门后喂养。但需要注意的是,幽门后喂养易引发小肠扩张,少数引起穿孔,故不作常规推荐。尽管缺乏科学依据,欧洲危重病学会腹部疾病工作组将24小时残留量>1000ml作为异常胃排空的一项指征,需要给予特殊的关注。治疗方面,高度胃潴留时推荐使用上消化道促动力药物,如甲氧氯普胺(即胃复安)或红霉素等,但不推荐常规使用全消化道促动力药物,如必利类药物。尽可能避免或减少使用阿片类药物,降低镇静深度。
5.腹泻 稀水样便每日>3次,且大便量>200g/d或250ml/d,则称为腹泻。常规的腹泻分为动力型、分泌型、渗透型和渗出型,但重症患者的腹泻分类更习惯于从病因角度来分,分为疾病本身相关(如短肠综合征的患者)、药物相关(如抗生素相关性腹泻)、食物或喂养相关(肠内营养不耐受等)。
对于重症患者腹泻的治疗,主要有对症治疗和对因治疗。对症治疗包括调整水电解质平衡、维持血流动力学稳定及脏器功能保护,如纠正低血容量以防止肾功能损害等。可能的病因主要包括药物性的因素、疾病本身的因素以及营养耐受不良等原因,因此对因治疗方面包括停用通便药物、山梨醇、乳果糖、抗生素等药物;治疗吸收功能障碍、炎症性肠病等疾病本身的问题;对于肠内营养不耐受导致的腹泻,可以通过减慢喂养速度、重新放置营养管或稀释营养配方。加入膳食纤维延长食物转运时间。此外,近年来常有报道的严重或反复发作的难辨梭状芽孢杆菌相关性腹泻,对于此类腹泻的治疗,目前认为口服万古霉素优于甲硝唑。
6.胃肠道出血 指任何进入胃肠道内腔的出血,并经呕吐液、胃内容物或粪便等标本隐血试验证实。治疗上对于明显的胃肠道出血,血流动力学状态决定治疗策略。伴有血流动力学障碍的出血,内镜检查可以明确诊断。但活动性和大量出血时,除了内镜检查,血管造影术是合适的选择。推荐早期(24小时之内)上消化道内镜检查,而急性静脉曲张出血需要更紧急(12小时之内)的干预。联合使用肾上腺素和血管夹、热凝固术或注射组织硬化剂等方法。不推荐常规复查内镜,当再出血时,推荐复查内镜。上消化道内镜检查阴性的胃肠道出血,需进行结肠镜检查,而结肠镜亦阴性时,可使用推进式电子小肠镜探查小肠。内镜检查阴性的活动性消化道出血,需考虑内镜手术或介入治疗。
7.下消化道麻痹 下消化道麻痹指肠蠕动功能受损,导致粪便不能排出体外。临床症状包括至少3天肛门停止排便,肠鸣音存在或消失,同时需排除机械性肠梗阻。在ICU之外的科室,便秘和顽固性便秘还包括不舒服的肠道蠕动、排便困难和疼痛等症状。而ICU患者无法表达上述症状,故建议使用“下消化道麻痹”这个概念。
治疗上尽可能停用抑制胃肠动力药物(如儿茶酚胺类、镇静药、类罂粟碱等),纠正损害胃肠动力的机体状态(如高血糖、低钾血症等),同时可使用促胃肠动力药物。通便药物由于有一定的延迟效应,因此可早期使用或预防性使用。
8.肠管扩张 腹部X线平片或CT上测得小肠直径>3cm,结肠直径>6cm(盲肠直径>9cm),则称为肠管扩张。常见的原因包括肠梗阻、中毒性巨结肠、Ogilvie综合征等。(https://www.daowen.com)
治疗方面,首先要注意纠正水、电解质失衡,鼻胃管减压可能有效,但对于择期开腹手术的患者不推荐常规放置鼻胃管。排除机械性梗阻后,对于盲肠直径>10cm而在24小时内无缓解,应考虑静脉使用新斯的明;若保守治疗24~48小时仍无效,推荐行使用结肠镜进行非外科减压,结肠镜减压有效率达80%,但存在一定风险。当盲肠直径≤12cm时,联合结肠镜减压的保守治疗可以持续48~72小时。保守治疗无效者,由于存在穿孔的风险,建议行外科手术治疗。使用胸椎硬膜外麻醉的腹腔镜手术,术后一定程度上可以改善肠道功能,预防肠管扩张。
(二)AGI分级与治疗
AGI分级整合了胃肠功能损伤的风险因素、胃肠道症状、腹腔压力及全身情况等,分为四级,具体如下。
Ⅰ级:有发展为胃肠功能障碍或衰竭的风险,表现为胃肠功能的部分受损,例如腹部手术后第一天的恶心、呕吐、肠鸣音减弱,休克早期的肠蠕动减少。这种胃肠损伤多为暂时性的、自限性的,常伴随一般情况的好转而消失,无须特殊处理,推荐损伤后24~48小时内行早期肠内营养。
Ⅱ级:胃肠功能障碍,表现为急性发生的胃肠道症状,胃肠道的消化吸收功能受损,需要外界干预才能满足机体对营养物质和水分的需求,如胃轻瘫伴高度胃残留或反流、下消化道麻痹、腹泻、腹高压Ⅰ级(IAP 12~15mmHg)、肉眼可见胃内容物或粪便内有血、喂养不耐受(72小时内的喂养尝试仍然不能通过肠内途径达到每日20kcal/kg的喂养目标)。治疗方面主要是治疗腹高压,促进胃肠动力的恢复及高度胃残留的处理。
Ⅲ级:胃肠功能衰竭,即使外界干预,胃肠功能也无法恢复。表现为持续性的肠内营养不耐受,治疗后仍无法改善,可能导致MODS的持续或加重,如持续性的胃肠麻痹、出现肠管扩张或进一步加重、腹高压进展为Ⅱ级(IAP 15~20mmHg)、腹腔灌注压<60mmHg。治疗方面主要包括IAH的监测及靶向性治疗,同时注意排除腹部可能存在的其他问题,如胆囊炎、腹膜炎、肠缺血等,定时尝试小剂量肠内营养;在入ICU的最初7天内,若肠内营养无法达到目标热卡量,不推荐使用肠外营养来补充,因为其可能会增加院内感染的发生率。
Ⅳ级:胃肠功能衰竭伴有远隔器官功能的严重损害,直接或立即威胁生命,同时加重MODS及休克,如肠管缺血坏死,胃肠道出血导致失血性休克,需要减压的ACS,Ogilvie综合征等,应立即行开腹手术或其他急诊干预措施以挽救生命,无有效的非手术治疗方案。
欧洲重症医学会的腹部问题工作小组推出的这一推荐,制定了重症患者胃肠功能及胃肠功能障碍的相关规范,为今后胃肠功能问题的共同研究与探讨奠定了基础,值得肯定。提出的AGI分级,暂时弥补了急性胃肠功能障碍或损伤评价系统的缺失,但AGI分级的临床实用性和可靠性有待进一步验证。因此,胃肠功能的评估系统仍然需要重症医学者的共同探索与改进,影像、超声等辅助诊断技术的发展将有望为重症患者胃肠功能的评估和急性胃肠功能障碍/AGI的早期诊断提供有力的支持。
(三)AGI患者的处理流程
见图12-1。
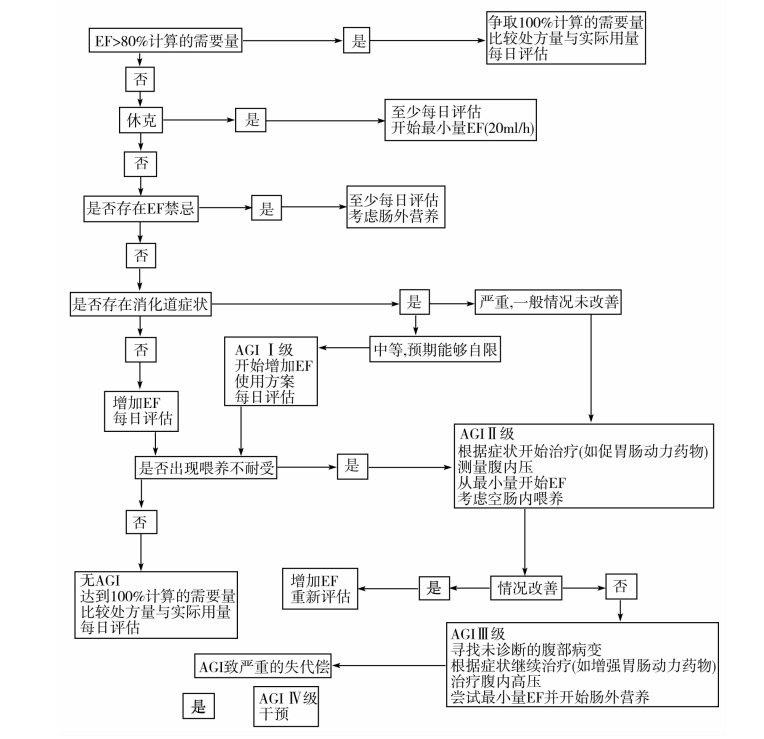
图12-1 AGI患者的处理流程
(李 华)
