一、热力学基础
这一部分是原理部分的第一个内容,是大一新生开始学习该课程的第一个内容,也是第一个难点,好多学生在上完该部分的第一节课就感觉“被打蒙了”,所以对该部分的教学尽量放慢速度,让从高中阶段进入大学学习的新生们逐渐适应大学的教学特点,逐步建立适合大学学习的学习方法。以下几个知识点是学生在学习中容易出现混淆和混乱的地方,在讲解时要重点讲清楚。
(一)反应进度
这是讲解基本概念和术语中比较重要的一个概念,后面的热力学概念中经常要用到,除了将其定义式介绍清楚,还要强调反应进度与化学反应方程式的写法有关,说反应进度一定要指明是那个化学反应,以及反应方程式的写法,即反应物、生成物的计量系数要确定,这样再讨论反应进度才有意义。![]()
(二)反应焓变ΔrH、标准摩尔反应焓变
、标准摩尔生成焓![]()
当讨论化学反应的反应焓变(ΔrH)时,意味着该化学反应是在等温、恒压、不做非体积功的条件下进行的,单位为kJ;讨论摩尔反应焓变(ΔrHm),意味着该化学反应按照给定的化学反应计量方程式,反应进度为lmol时的反应焓变,单位为kJ·mol-1;若该化学反应在处于温度为T的标准状态时,该反应的摩尔反应焓变即为标准摩尔反应焓变![]() ,单位为kJ·mol-1,一般温度T为298.15K时,T可以不标出。在温度T及标准状态下,由稳定的纯态单质生成1 mol物质B时(B为唯一生成物),该反应的标准摩尔反应焓变
,单位为kJ·mol-1,一般温度T为298.15K时,T可以不标出。在温度T及标准状态下,由稳定的纯态单质生成1 mol物质B时(B为唯一生成物),该反应的标准摩尔反应焓变![]() 即为物质B的标准摩尔生成焓
即为物质B的标准摩尔生成焓![]() ,根据此定义稳定的纯态单质标准摩尔生成焓为零。如合成氨反应:
,根据此定义稳定的纯态单质标准摩尔生成焓为零。如合成氨反应:
![]()
则氨气的标准摩尔生成焓![]() ,氮气、氢气的标准摩尔生成焓
,氮气、氢气的标准摩尔生成焓![]() 均为零。将
均为零。将![]() 的概念讲清楚,到后续的有关的概念就容易讲解学生也容易理解了。
的概念讲清楚,到后续的有关的概念就容易讲解学生也容易理解了。
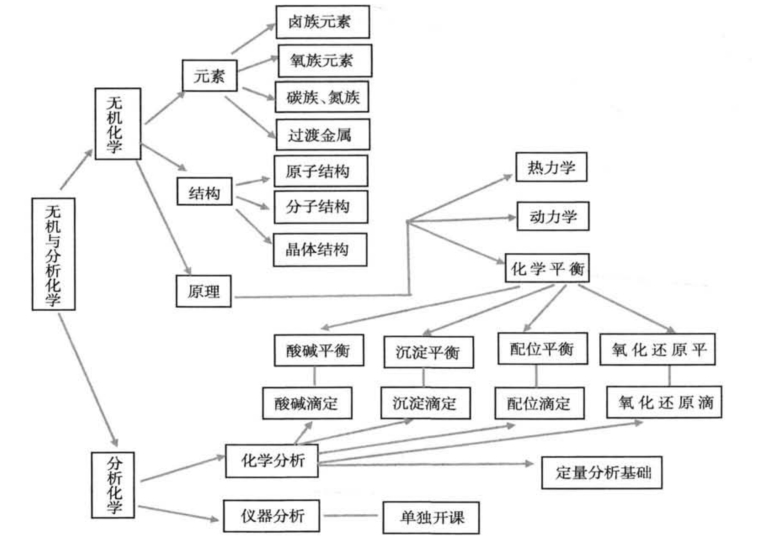
图1 无机及分析化学课程“知识树”主干示意图
(三)有关化学反应的摩尔反应焓变ΔrHm、摩尔反应熵变ΔrSm、摩尔反应吉布斯自由能变ΔrGm的计算
这部分内容是盖斯定律的具体应用,而盖斯定律在中学时学生已经学习过,有基础,同时这部分内容到物理化学中还要进一步学习,因此对这部分的内容可以简单介绍,不要求学生掌握,了解即可。
(四)有关氧化还原方程式的配平:离子-电子法
在氧化还原平衡这一部分的内容中,首先要讲解的是氧化还原反应方程式的配平。中学里学生学过用氧化数法配平反应方程式,因此重点介绍离子-电子法配平。学生通常认为只要把方程式配平了就可以,不理解为什么要学习离子-电子法。其实,学会这种配平方法,不仅能准确的配平氧化还原反应方程式,还对后边学习内容的理解和掌握有很大的帮助,如根据氧化还原反应方程式写出原电池符号,根据原电池符号写出氧化还原反应方程式,能斯特方程的应用,H+浓度对电极电势影响等。
先说能斯特方程,首先需要正确的写出电极反应,酸性、碱性的介质条件不同,电极反应式的写法也不同。如在酸性介质中,跟氧有关的电对O2/H2O2,H2O2/H2O,到碱性介质中则为![]() -,
-,![]() ,对应的电极反应分别为:
,对应的电极反应分别为:
酸性介质:O2+2H++2e![]() 2H2O2
2H2O2
H2O2+2H++2e![]() 2H2O
2H2O
碱性介质:![]()
![]()
这些电极反应均为用离子-电子配平氧化还原反应方程式时所写出的半反应。根据这些电极反应也很容易就明白在写能斯特方程时,H+、OH-写在什么位置上。
再说原电池符号和氧化还原反应方程式之间的相互书写。如学生很熟悉的铜锌置换反应:
Cu2++Zn→Cu+Zn2+
用离子电子法配平:Cu2++ 2e =Cu(还原半反应)
Zn-2e =Zn2+(氧化半反应)
将两个半反应加合,即得到配平了的总反应
Cu2++ Zn=Cu + Zn2+
将上述设计成原电池时,正极发生还原反应,负极发生氧化反应,组成电极的物质为参与氧化反应、还原反应的所有物质,所以铜锌原电池的符号为:
(-)Zn | Zn2+ (c1)||Cu2+ (c2)|Cu(+)
对于将较为复杂的氧化还原反应设计成原电池,是很多学生感觉有难度的地方,包括到后续课程物理化学的学习中。但是从离子电子法配平氧化还原反应方程式出发,再设计原电池,就容易理解的多了。如![]()
用离子电子法配平:![]()
![]()
将两个半反应乘相应的系数,加合,即得到配平了的总反应![]()
设计原电池时,参考两个半反应中的物质,很容易写出原电池符号:
![]()
