二、分步沉淀
当两种离子同时存在于一个体系中,而且这两种离子可与同一种沉淀剂形成沉淀,则存在两种离子先后沉淀的问题;当第二种离子开始沉淀时,需判断第一种离子的剩余浓度问题,两种离子能否实现分离的问题。
(一)判断两种离子哪种先沉淀
在有关分步沉淀中,最先遇到的一个问题就是判断哪种离子先沉淀。
1.相同类型的难溶电解质
对于相同类型的难溶电解质,两条溶度积常数曲线互相平行。
当两种离子的初始浓度相同,如溶液中存在Cl-和Br-,且它们的浓度都为0.1 mol· L-1,如图2a中的A、B两点所示,向溶液中逐滴加入Ag+离子,由图可以看出,当Br-离子开始沉淀时,需要的Ag+离子浓度为c(Ag+):A,而当Cl-离子开始沉淀时,需要的Ag+离子浓度为c(Ag+):B,由于c(Ag+):A<c(Ag+):B,故Br-离子先沉淀。
若两种离子的初始浓度不同,如溶液中存在Cl-和Br-,且Cl-离子浓度为0.1 mol· L-1,Br-离子浓度为0.005mol· L-1,如图2(a)中的B、C两点所示,向溶液中逐滴加入Ag+离子,由图可以看出,当Br-离子开始沉淀时,需要的Ag+离子浓度为c(Ag+):C,而当Cl-离子开始沉淀时,需要的Ag+离子浓度为c(Ag+):B,由于c(Ag+):C<c(Ag+):B,故Br-离子先沉淀。
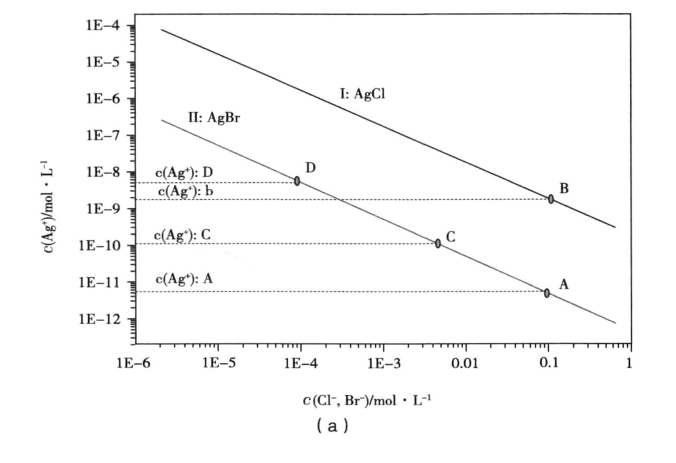
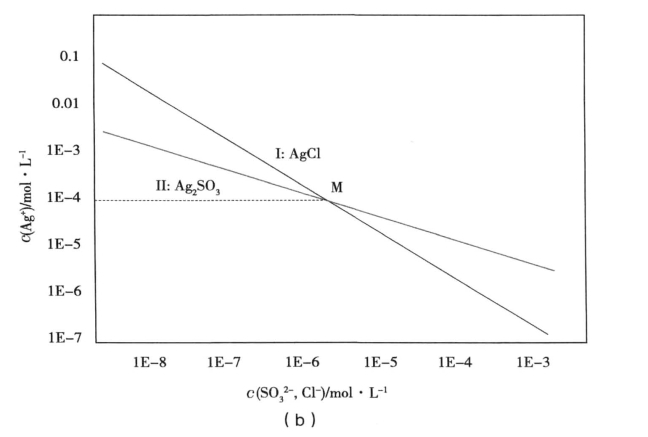
图2 分步沉淀顺序示意图
如溶液中存在Cl-和Br-,且Cl-离子浓度为0.1mol· L-1,Br-离子浓度为0.0001mol· L-1,如图2a中的B、D两点所示,向溶液中逐滴加入Ag+离子,由图2(a)可以看出,当Br-离子开始沉淀时,需要的Ag+离子浓度为c(Ag+):D,而当Cl-离子开始沉淀时,需要的Ag+离子浓度为c(Ag+):B,由于c(Ag+):B<c(Ag+):D,故Cl-离子先沉淀。
2.不同类型的难溶电解质
若两种沉淀类型不相同,则两条溶度积常数曲线不平行,当两种沉淀的溶度积常数相差不是很多时,会出现交叉,如图2(b)所示。
若溶液中Cl-和![]() 两种离子的初始浓度相同,都位于M点,则两种离子沉淀所需的Ag+离子浓度相同,故同时沉淀;若两种离子的初始浓度位于M点右侧,此时,AgCl的溶度积曲线在Ag2SO3溶度积曲线下方,因此Cl-离子沉淀时所需Ag+离子浓度小,故Cl-离子先沉淀;若两种离子的初始浓度位于M点左侧,此时,AgCl的溶度积曲线在Ag2SO3溶度积曲线上方,因此
两种离子的初始浓度相同,都位于M点,则两种离子沉淀所需的Ag+离子浓度相同,故同时沉淀;若两种离子的初始浓度位于M点右侧,此时,AgCl的溶度积曲线在Ag2SO3溶度积曲线下方,因此Cl-离子沉淀时所需Ag+离子浓度小,故Cl-离子先沉淀;若两种离子的初始浓度位于M点左侧,此时,AgCl的溶度积曲线在Ag2SO3溶度积曲线上方,因此![]() 离子沉淀时所需Ag+离子浓度小,故
离子沉淀时所需Ag+离子浓度小,故![]() 离子先沉淀。
离子先沉淀。
若两种离子浓度不同,则按照前面所述,找出与该点对应的纵坐标,比较其相对大小,数值小的先沉淀即可。
总之,与利用溶度积规则来判断哪种离子先沉淀一样,看哪种离子沉淀时所需沉淀剂浓度越小,则哪种离子就先沉淀出来,用图示法表示可以更直观。
(二)计算当第二种离子开始沉淀时,第一种离子的剩余浓度
计算这类问题时应该考虑到的是,当第一种离子已经沉淀后,再向溶液中加入沉淀剂,会使第一种难溶化合物的沉淀溶解平衡发生移动,随着沉淀剂在体系中的浓度增大,第一种离子的浓度减小。例如图3所示,溶液中存在Cl-和Br-,且它们的浓度都为0.01 mol· L-1 ,我们首先可以判断,Br-先沉淀,此时A g+离子浓度为c(Ag+):A,继续加入Ag+离子,Ag+离子浓度不断增大,而Br-离子浓度不断减小,体系中始终维持着AgBr的沉淀溶解平衡,Ag+离子和而Br-离子浓度会沿着AC曲线运动。当Ag+离子浓度达到c(Ag+):B时,Cl-离子开始沉淀,而Br-离子浓度达到C点所对应的横坐标数值,即2.8×10-5mol· L-1。
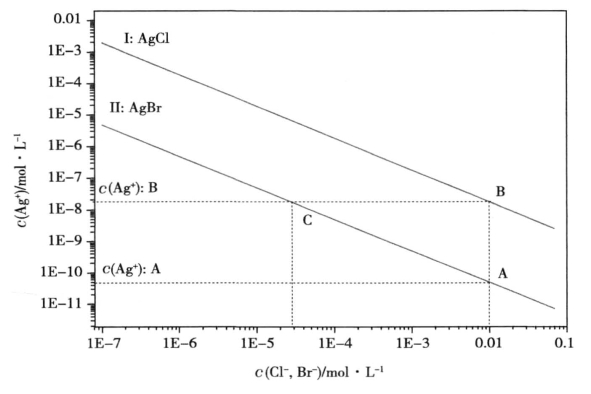
图3 第二种离子沉淀时,计算第一种离子浓度示意图
(三)判断两种离子能否利用沉淀的方法分离
在沉淀溶解平衡中还经常遇到的一类问题是判断两种离子能否用一种沉淀剂分离。这里涉及沉淀完全的概念:一般来说,溶液中离子剩余浓度小于或等于1.0×10-5mol· L-1,就可以认为该离子被定性沉淀完全了;对于重量分析,被沉淀组分应达到定量沉淀完全,则要求沉淀后溶液中剩余被沉淀离子的浓度应小于或等于1.0×10-6mol· L-1。判断离子能否完全分离时,有些采用定性完全标准,[3,4]有的采用定量完全标准。[5]以下以1.0×10-5mol· L-1为标准进行说明。
这部分内容实际是上述内容的综合。先判断哪种离子先沉淀,然后计算当第二种离子沉淀时,第一种离子的剩余浓度,若是大于1.0×10-5mol· L-1 ,则无法完全分离;若是小于1.0×10-5mol· L-1,则可以完全分离。或者,计算当第一种离子沉淀完全时(1.0×10-5mol· L-1)所需沉淀剂浓度,若是小于第二种离子开始沉淀时所需沉淀剂浓度,则可以完全分离,如图4(a)所示:溶液中存在Fe3+离子和Cu2+离子,它们的浓度均为0.1mol·L-1,若要采用控制溶液pH值的方法能否完全分离。由图4(a)中可以发现,Fe 3+离子开始沉淀时所需OH-离子浓度为c1(Fe3+),Cu2+离子开始沉淀时所需OH-离子浓度为c1(Cu2+),而Fe3+离子沉淀完全所需OH-离子浓度为c2(Fe3+),c2(Fe3+)< c1(Cu2+),因此两种离子可以完全分离,由图可知,将溶液的pH值控制在3.2-4.7之间即可。
反之,若是第一种离子沉淀完全时(1.0×10-5mol· L-1)所需沉淀剂浓度大于第二种离子开始沉淀时所需沉淀剂浓度,则无法完全分离,如图4(b)所示。
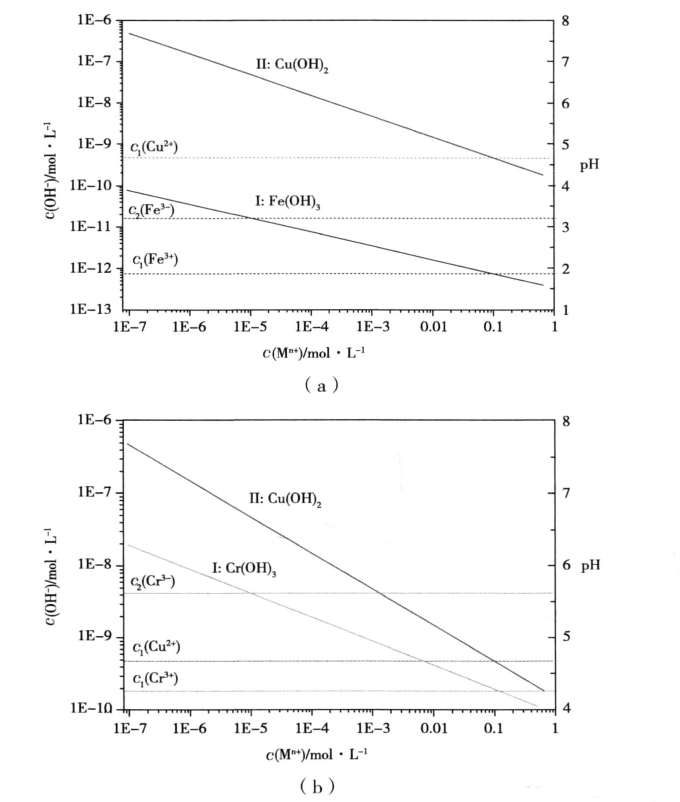
图4 沉淀能否完全分离示意图
