一、溶度积规则
对于任意难溶物AnBm,在水溶液中存在下列沉淀溶解平衡:![]()
![]()
该平衡的平衡常数称为溶度积常数,用表示:
![]()
严格来说,溶度积常数表达式中应为离子活度,但因溶液中难溶电解质的离子浓度很低,活度系数的数值接近于1,故离子浓度和活度相差很小,在不要求特别精确计算时,可用离子浓度代替活度而不会引起很大的误差。[1]
对于一给定的难溶电解质来说,在一定条件下判断沉淀能否生成或溶解,可以从溶度积的概念来判断。难溶电解质溶液中,其离子浓度幂的乘积称为离子积,用![]()
![]() ,其中c为任意情况下离子浓度)表示,根据Qi与
,其中c为任意情况下离子浓度)表示,根据Qi与![]() 的关系,可以判断沉淀的生成或溶解,称为溶度积规则。
的关系,可以判断沉淀的生成或溶解,称为溶度积规则。
(1)![]() 时,溶液为过饱和溶液。平衡向生成沉淀的方向移动,生成沉淀,直到达成新的平衡为止,所以
时,溶液为过饱和溶液。平衡向生成沉淀的方向移动,生成沉淀,直到达成新的平衡为止,所以![]() 是沉淀生成的条件。
是沉淀生成的条件。
(2)![]() 时,溶液为饱和溶液。处于平衡状态,不生成沉淀。若有沉淀存在,其量不增也不减。
时,溶液为饱和溶液。处于平衡状态,不生成沉淀。若有沉淀存在,其量不增也不减。![]()
(3)时,溶液为未饱和溶液。若溶液中有难溶电解质固体存在,就会继续溶解,直至饱和为止,所以![]() 是沉淀溶解的条件。
是沉淀溶解的条件。
以氯化银为例,用图示法可以直观地看出沉淀生成和溶解的情况:
图1为氯化银的溶度积曲线(以两种离子浓度分别为横、纵坐标,将两种离子浓度乘积等于的点连起来得到),当溶液处于某种状态,若该点位于曲线右上方即图中B区,则有沉淀生成;若位于左下方即图中A区,则没有沉淀生成,或沉淀溶解。若刚好位于曲线上,则是沉淀溶解体系的平衡状态。若改变条件使该点移至A区或B区,则同样会发生沉淀的溶解或生成。
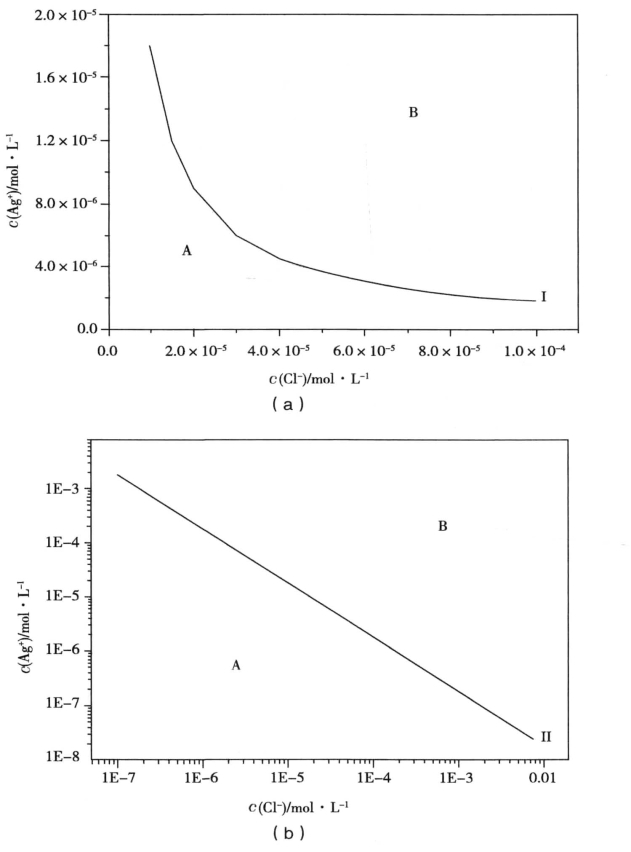
图1 氯化银的溶度积曲线
当初始状态位于B区的某体系达到平衡时,会存在AgC1沉淀和饱和溶液,如状态Ⅰ(如图1(a),此时,若再向体系中加入氯离子,氯化银的沉淀溶解平衡向生成沉淀的方向移动,达到新的平衡如状态Ⅱ(如图1(b))时,溶液中剩余的银离子浓度会减小,即随着沉淀剂的量逐渐增加,溶液中剩余的被沉淀离子浓度越来越小,这一现象称为同离子效应。利用同离子效应,当采用沉淀法除去某种离子时,为了沉淀完全,一般加入过量的沉淀剂,[2]但考虑到盐效应,也不能过量太多。
