睾丸细胞结构
1.间质
(1) 间质细胞(Leydig cell):睾丸间质含有血管、淋巴管、成纤维细胞、巨噬细胞、肥大细胞和间质细胞(图2-8)。间质细胞负责大部分睾丸类固醇的产生。间质细胞在妊娠第7周时由间充质前体细胞分化而来。间质细胞类固醇生成的激活,与男性生殖系统雄激素依赖性分化的发生有关。间质细胞在对LH起反应之前就已经表达类固醇生成酶(El-Gehani et al,1998;Majdic et al,1998)。间质细胞也可在LH、胎盘源人绒毛膜促性腺激素(hCG),以及局部旁分泌因子[如胰岛素样生长因子-1(IGF-1)]的影响下从前体细胞分化而来(Huhtaniemi and Pelliniemi,1992;Teerds and Dorrington,1993;Le Roy et al,1999)。在垂体促性腺激素的作用下,间质细胞在出生后2~3个月时开始第二波分化,表现为睾酮水平短暂性升高。男性新生儿早期产生的雄激素可作用于下丘脑、肝和前列腺,使其对后续的雄激素刺激做出适当的反应。分析数据显示,HPG轴在青春期再次激活后,年轻成年男性的单个睾丸中含有大约7亿个间质细胞(Kaler and Neaves,1978)。
(2)睾酮:由胆固醇合成的睾酮是睾丸产生的主要类固醇(Lipsett,1974)。此过程还产生许多C18、C19和C21类固醇(Lipsett,1974;Ewing and Brown,1977)。胆固醇运送到间质细胞线粒体后,由胆固醇侧链切割酶将其转化为孕烯醇酮。间质细胞中胆固醇来源主要有三种:①外源性,来自血液中的脂蛋白和内部的胆固醇-脂蛋白受体复合物;②醋酸盐的从头合成;③储存在脂滴中的胆固醇酯。维持胆固醇储存是正常间质细胞功能的一部分,LH刺激通过激活胆固醇酯酶活性唤起胆固醇动员。孕烯醇酮从线粒体膜转运到光面内质网中,并在此转化为睾酮。睾酮扩散穿过细胞膜并在细胞外液和血浆中被类固醇结合蛋白捕获。
胆固醇向线粒体内膜的转运受类固醇激素合成急性调节蛋白(StAR)和外周苯二氮 受体(PBR)两种转运蛋白调节。LH在间质细胞内结合St AR,穿过线粒体外膜促进胆固醇转运(Stocco,2000)。在线粒体膜内PBR形成胆固醇转运通道(Culty et al,1999),但PBR是否与St AR在功能上相互作用尚不清楚(West et al,2001)。
受体(PBR)两种转运蛋白调节。LH在间质细胞内结合St AR,穿过线粒体外膜促进胆固醇转运(Stocco,2000)。在线粒体膜内PBR形成胆固醇转运通道(Culty et al,1999),但PBR是否与St AR在功能上相互作用尚不清楚(West et al,2001)。
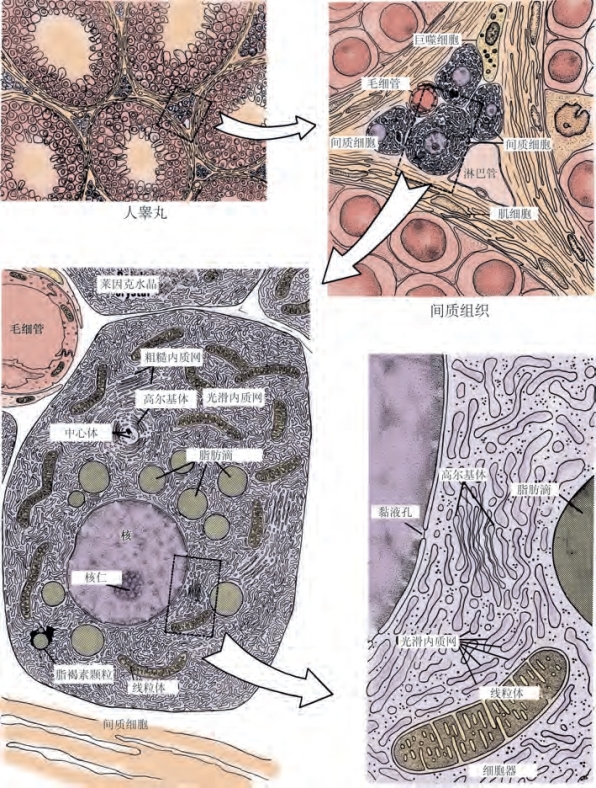
图2-8 人类间质细胞的显微镜下结构。睾丸间质细胞在生精小管间的间质内呈簇出现(左上)。间质组织(右上)包含巨噬细胞、成纤维细胞、毛细血管和淋巴管。间质细胞胞质内最丰富的细胞器是光面内质网(左下)。显示更详细的细胞器(右下)(From Christensen AK.Leydig cells.ln:Greep RO,Astwood WB,editors.Handbook of physiology.Baltimore:Williams&Wilkins;1975.Copyright 1975,American Physiological Society,Bethesda,MD.)
四种主要参与从孕烯醇酮至睾酮生物合成的酶是胆固醇侧链切割酶、3β-羟基类固醇脱氢酶、细胞色素P450 17α-羟化酶/C17-20-裂解酶,以及17β-羟基类固醇脱氢酶。这些酶的酶学、染色体位置和分子遗传学已经被很好地描述(Payne and Hales,2004)。编码这些酶的基因可发生突变,并由此导致雄激素生物合成障碍,在染色体正常男性中引起相对罕见的男性表型不典型(Miller,2002)。
(3)睾酮合成的调控:间质细胞类固醇生成的调控非常复杂,涉及垂体和非垂体因素(Payne and Youngblood,1995)。睾酮产生最重要的调控因素是LH。在第二信使cAMP结合LH后,间质细胞启动胆固醇向线粒体转运。垂体分泌的其他肽类激素(如FSH和催乳素)则能够改变间质细胞对LH的反应性(Ewing,1983)。另一方面,能够改变间质细胞产生睾酮的非垂体因素包括Gn-RH(Sharpe,1984);抑制素和激活素(Bardin et al,1989);表皮生长因子(EGF),IGF-1和TGF-β(Ascoli and Segaloff,1989;Saez et al,1991);前列腺素(Eik-Nes,1975)及肾上腺素能刺激(Eik-Nes,1975)。此外,雌激素和雄激素也可以直接抑制间质细胞合成睾酮(Ewing,1983;Darney et al,1996)。
(4)睾酮周期:在人类胎儿、新生儿和成年期,血清睾酮水平发生着显著变化。图2-9显示在孕龄12-18周的胎儿中出现睾酮峰值。另一个睾酮峰值约在出生2个月龄时发生。第三个睾酮峰值出现在生命的第二或第三个十年期间。在此之后,有一个平台期,然后随着年龄的增长缓慢下降。上方叠加的是睾酮产生的年度、日常节律(图2-9A和B)和睾酮的不规则日常波动(图2-9,C)。这些人类生命中睾酮生产时期的变化反映了垂体和睾丸之间复杂的相互作用。睾酮峰值在时间上对应于四个发育事件:①胎儿生殖道的分化和发育;②雄激素依赖性靶组织的“印迹”或新生儿机体发育;③青春期的男性化特征;④维持成年人雄激素依赖器官的生长和功能。Swerdloff和Heber(1981)曾对此进行全面的回顾分析。

图2-9 生命周期中男性外周血睾酮水平。胎儿睾酮峰值出现在妊娠12-18周(左下角;胎龄未显示)。新生儿高峰出现在大约两个月大的时候。睾丸激素在青春期前降至低水平。青春期睾酮升高发生在12-17岁。成年人睾酮浓度在生命的第二或第三个十年达到最大值,然后缓慢下降。衰老期睾酮显著下降。插图A显示了男性睾酮浓度的年度节律,峰值和最低点分别出现在秋季和春季。插图B显示睾酮浓度的每日节律,峰值和谷值分别发生在早晨和夜间。插图C显示睾酮浓度频繁不规则波动(From Ewing LL,Davis JC,Zirkin BR.Regulation of testicular function:a spatial and temporal view.ln:Greep R O,editor.lnternational review of physiology.Baltimore:University Park Press;1980.p.41.)
2.生精小管
生精小管由生殖细胞和支持细胞组成,是配子产生的独特环境。构成生精微环境的细胞包括支持细胞、纤维细胞,以及基底膜的肌样细胞。生殖细胞包括分裂缓慢的干细胞群、增殖较快的精原细胞和精母细胞,以及变形中的精子细胞。
(1)支持细胞(Sertoli cell):支持细胞位于生精小管的基底膜并延伸至管腔(图2-10)。支持细胞的超微结构特征已有确切描述(Bardin et al,1994),具有不规则形状的细胞核、突出的核仁及较低的有丝分裂指数,并且在相邻的支持细胞之间有独特的紧密连接复合物。这些紧密连接是人体内最强的细胞间屏障,将生精小管分为基底膜侧和管腔侧(见图2-10)。这种解剖结构形成了血-睾屏障的基础,允许精子在免疫保护的特定区域进行分化。支持细胞作为精子发生的保育细胞,胞质内和胞质间的胞质突起不断滋养发育中的生殖细胞。未分化的精原细胞靠近小管的基底膜,而精母细胞和精子细胞靠近管腔内表面。因此支持细胞是一种极化的上皮细胞,其基底近似血浆环境,其顶端则构成生精小管内的特有环境(Ewing et al,1980)。
 (https://www.daowen.com)
(https://www.daowen.com)
图2-10 树状支持细胞的代表性结构 具有增厚的中央部分可称为“躯干”,较为脆弱的触角可称为“四肢”,注意生精上皮的基底室、中间室和近腔室。A.精原细胞和早期精母细胞在基底层共享空间,并被相邻的支持细胞包裹,支持细胞连接形成紧密连接复合物(血-睾屏障的部位)。B.在生精细胞从基底室移到近腔室的过程中,支持细胞在细线-偶线期精母细胞的上下方形成连接复合物。C.支持细胞紧密连接解离时,精母细胞进入管腔内。D.伸长的精子细胞位于支持细胞躯干的狭窄凹陷内。E.当精子细胞进一步伸长时,细胞就会滞留在支持细胞体内。分化成熟的精子细胞向管腔移动,为最终成为精子做准备。只有精子头部仍然与支持细胞保持密切接触。特异的细胞间接触:星号,桥粒缝隙连接复合物;箭头,细胞外质特化;单向箭头,小管复合物(From Russell L.Sertoli-germ cell interactions:a review.Gamete Res 1980;3:179.)
支持细胞通过以下方式滋养生殖细胞发育:①提供特有的腔内微环境;②通过支持细胞与生殖细胞之间的缝隙连接滋养生殖细胞;③允许发育中的生殖细胞在小管内迁移(见图2-10)。通过支持细胞之间的紧密连接不断改变结构,“开放”和“关闭”生殖细胞的相互作用和迁移(Mruk and Cheng,2004)。配体-受体复合物,如c-kit和kit配体,可能参与调节生殖细胞和支持细胞之间的联系。支持细胞也参与生殖细胞的吞噬、产生和分泌液体,以及重要的效应分子。雄激素结合蛋白(ABP)是最早描述的支持细胞的分泌产物之一(Hansson and Djoseland,1972)。ABP是支持细胞内雄激素的细胞载体。通过结合睾酮,ABP在生精小管内维持高水平的雄激素(比血清高50倍)。睾酮在支持细胞功能的调节中也起重要作用,包括ABP的产生(Griswold et al,1988)。抑制素由支持细胞产生,并在FSH分泌的负反馈环中起着重要的调节作用。抑制素B是男性不育症评估中,反映支持细胞功能的重要内分泌标志物。
支持细胞作为睾丸免疫保护区的维持者,确保生殖细胞的微环境完全不同于血浆。因此,支持细胞分泌许多其他产物,包括细胞外基质成分(纤维蛋白原、Ⅳ型胶原蛋白和Ⅰ型胶原蛋白)和一些蛋白质,如血浆铜蓝蛋白、转铁蛋白、糖蛋白2、纤溶酶原激活物、类生长调节素样物质、T蛋白、HY抗原、丛生蛋白、环状蛋白、生长因子和生长调节素(Mruk and Cheng,2004)。类固醇如DHT、睾酮、雄烯二醇、17β-雌二醇和许多其他C21类固醇也由支持细胞产生(Ewing et al,1980;Mather et al,1983)。许多支持细胞和管周物质的功能尚不清楚,应进一步探明支持细胞如何精细调控以维持精子发生。
(2)生殖细胞:在人类生精小管中,生殖细胞每天产生大约123×106[范围(21~374×10 6)]个精子(Amann and Howards,1980)。这相当于每次心搏产生大约1200个精子。在生精小管内,生殖细胞从基底膜到管腔呈现高度有序排列。各种生殖细胞的形态学分析揭示了人类睾丸中至少有13种可识别的生殖细胞类型(Clermont,1963;Heller and Clermont,1964)(图2-11)。每种细胞类型被认为代表生精进程中的一个不同步骤。从形态学外观上看,它们从最小分化到完全分化,命名为暗A型精原细胞(Ad)、亮A型精原细胞(Ap)、B型精原细胞(B)、细线前期(R)、细线期(L)、偶线期(Z)和粗线期(P)初级精母细胞,次级精母细胞(ll)和Sa、Sb、Sc、Sd 1和Sd 2精子细胞。紧密连接保持精原细胞和早期精母细胞处于基底室内,而所有其他生殖细胞位于近腔小室。

图2-11 精子发生的步骤。Ad.暗A型精原细胞;Ap.亮A型精原细胞;B.B型精原细胞;ll.次级精母细胞;L.细线期初级精母细胞;P.粗线期初级精母细胞;R.休眠或细线前期初级精母细胞;Rb.残余体;Sa(a)、Sb1 (b1)、Sb 2(b2)、Sc(c)、Sd 1(d1)、Sd 2(d2)。精子细胞;Z.偶线期精母细胞。该表显示了构成生精上皮“周期”六个阶段(l~Vl)的细胞:D1.终变期;lD和llD.精母细胞的第一次和第二次成熟分裂(Modified from Clermont Y.Renewal of spermatogonia in man.Am JAnat 1966;118:509.)
3.管周结构
人类生精小管被几层管周组织包绕(Hermo et al,1977)(图2-12)。外膜层由成纤维细胞组成,中间层是散布有薄层结缔组织的肌样细胞,内层由胶原蛋白基质组成。人类管周肌样细胞具有收缩功能(Toyama,1977)。肌样细胞主动分泌细胞外基质成分如纤连蛋白和Ⅰ型胶原,并产生内胶原层(Tung et al,1984)。肌样细胞也可能会影响支持细胞的功能,已知它与支持细胞和间充质上皮的精确相互作用相关联。Skinner和同事(1988)分离了由肌样细胞产生的旁分泌因子P-Mod-S(peritubular modifies Sertoli),可在体外对支持细胞的合成和分化功能产生显著影响。人类管周细胞也被证明可分泌睾酮并影响支持细胞活性(Cigorraga et al,1994)。
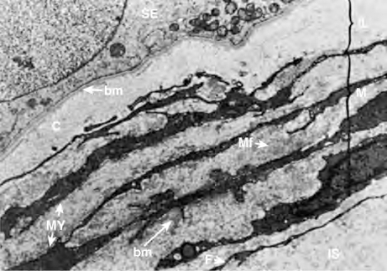
图2-12 人类睾丸管周组织的低倍电镜图片。管周组织位于生精上皮(SE)的基膜(bm)和间质组织(lS)之间。管周组织有三个区域:内层(lL);肌层(M),含有丰富微丝状结构(Mf)的肌细胞(MY);含有成纤维细胞的外膜层(F)(From Hermo L,Lalli M,Clermont Y.Arrangement of connective tissue elements in the walls of seminiferous tubules of man and monkey.Am J Anat 1977;148:433-46.)
4.血-睾屏障
染料和其他物质在注入动物血流时会迅速出现在身体组织中,但不能穿透大脑和睾丸区域,这就引出血-睾屏障的概念。可以更确切地称其为“血-生精小管屏障”,其由两个部分组成:解剖/机械单元和功能单元。机械屏障部分由围绕生精小管的肌样细胞形成(Dym and Fawcett,1970;Fawcett et al,1970)。分子交换调节也发生在毛细血管内皮细胞的水平。但屏障最重要的组成部分是支持细胞间的紧密连接,可阻止大分子和淋巴细胞的通过。血-睾屏障的解剖单元是必要的,但不足以维持小管内的免疫“保护区”状态,因为在生殖道的其他保护区中并未观察到这种解剖结构(Tung et al,1971;Brown et al,1972)。
因此,尽管机械屏障有助于血-睾屏障的建立,但其他“功能”组分也必须存在,以抑制正常的免疫应答。几种机制可能协同工作以保护精子免受破坏。首先,在生精上皮的解剖学薄弱区域,淋巴细胞被隔离(Mahi-Brown et al,1988)。其次,这些薄弱区域主要是T抑制细胞(el-Demiry et al,1985;Anderson and Hill,1988)。由于抗原-人类白细胞抗原结合的缺陷,导致精子抗原无法向淋巴细胞递呈,进而损害免疫应答(Jenkins et al,1987;Anderson and Hill,1988)。有证据表明,免疫耐受在功能性血-睾屏障中起作用。主导理论认为,在屏障的解剖较薄弱区域(睾丸网、输精管、附睾),存在精子抗原少量持续泄漏(Tung,1980)。该泄漏可产生T-抑制细胞和免疫耐受性,类似于常见环境过敏源的脱敏方案。然而,随着抗原逐渐增加,将会导致真正的免疫应答(Turek,1997)。细胞因子可能有助于免疫耐受,包括干扰素-γ、可溶性Fc受体和TGF-β(Perussia et al,1987;Ben-Rafael and Orvieto,1992;Turek,1997)。此外,雄激素具有轻度免疫抑制活性,并可调节免疫(Diemer et al,2003)。
为什么会存在血-睾屏障?血-睾屏障在青春期初次遗精时产生(Kormano,1967),可能对减数分裂很重要。此外,血-睾屏障可以免疫隔离出成年雄性免疫系统不能识别为自身发育中的雄性配子。从这个意义上讲,在青春期后,血-睾屏障的功能就能够完全实现,因为减数分裂后生精细胞上的外来“抗原”只有在初次遗精后才存在。如果在青春期之前发生睾丸损伤,如活检、扭转或创伤,则不会诱发抗精子抗体。然而,在青春期之后,免疫性不育是已知的风险(Turek,1997)。临床上,血-睾屏障还可能限制化疗药物进入癌细胞,与睾丸内癌症复发有关。
