(二)分类
目前,已经提出了很多ED的分类方法(图6-13)。有些根据病因分类(如糖尿病源性、医源性和创伤性等),有些根据神经血管发病机制分类(如神经性:性唤起障碍;动脉性:充血障碍;静脉性:静脉储血障碍)(Goldstein,personal communication,1990)。国际ED研究协会推荐的分类见框图6-1(Lizza and Rosen,1999)。
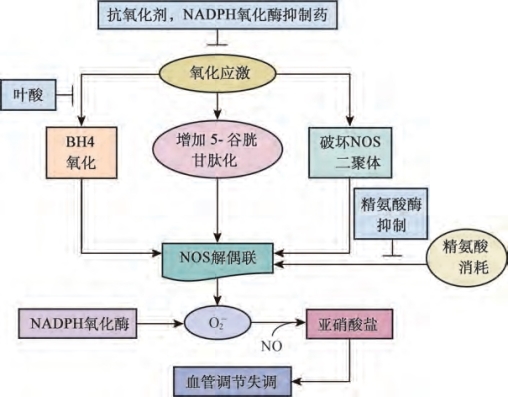
图6-13 导致一氧化氮合酶(NOS)解偶联的因素及可能的抑制剂。BH4.四氢生物蝶呤;NADPH.还原型烟酰胺腺嘌呤二核苷酸磷酸
1.心理性ED
以前,人们认为90%的ED是精神心理性的ED(Masters and Johnson,1965)。这种观点已经被ED可能主要是功能性或生理因素的混合状态的认识所取代。
性行为和阴茎勃起是由下丘脑、边缘系统和大脑皮质控制的。刺激或抑制信息可以传递到脊髓勃起中枢以促进或抑制勃起。有两种可能机制来解释心理障碍抑制勃起:大脑对脊髓勃起中枢的直接抑制,加强了正常的骶髓上抑制(Steers,2000),交感神经过度兴奋或升高了外周儿茶酚胺水平,这可能增加阴茎平滑肌的张力,阻止了其生理性松弛。动物研究表明,刺激交感神经或全身注射肾上腺素会导致勃起阴茎的疲软(Diederichs et al,1991a,1991b)。在临床上,心理性ED患者的血清去甲肾上腺素水平高于正常对照组或血管药物性ED患者(Kim and Oh,1992)。
Bancroft和Janssen(2000)认为,男性的性反应依赖于中枢神经系统兴奋性冲动和抑制性冲动之间的平衡,比如患有精神障碍的男子性功能障碍的发病率较高。Mosaku和Ukpong(2009)调查了精神分裂症、双相情感障碍、复发性抑郁和(或)药物使用障碍的患者(平均年龄39.6岁,标准差11.6岁),平均患病时间为10.24年(标准差8.2年)。在这一人群中,ED的患病率为83%,年龄、是否结婚、用药,以及是否存在并发症是ED的重要预测因素。

框图6-1 男性勃起功能障碍分类
2.神经性ED
据估计,10%~19%的ED是神经源性的,如果包括医源性病因和混合ED,患病率可能会更高。神经性疾病或神经病变的存在并不能排除其他原因,因此确认ED是神经源性的可能比较困难。因为勃起与神经血管相关,任何影响大脑、脊髓、海绵体神经或阴部神经的疾病或功能障碍都会导致勃起功能障碍。
如前所述,MPOA、PVN和海马被认为是性觉醒和勃起的重要整合中枢(Sachs and Meisel,1988),这些区域疾病,如帕金森病、中风、脑炎或颞叶癫 ,往往与ED有关。帕金森病的发生可能是多巴胺途径失衡的结果(Chaudhuri and Schapira,2009);其他与ED相关的脑损害包括肿瘤、认知障碍、阿尔茨海默病、多系统萎缩和创伤等。在对中风后男性性功能的研究中,人们发现性欲缺乏在他们之中很普遍(Jung et al,2008)。丘脑区有脑血管意外的患者中,ED患病率更高(Jeon et al,2009)。
,往往与ED有关。帕金森病的发生可能是多巴胺途径失衡的结果(Chaudhuri and Schapira,2009);其他与ED相关的脑损害包括肿瘤、认知障碍、阿尔茨海默病、多系统萎缩和创伤等。在对中风后男性性功能的研究中,人们发现性欲缺乏在他们之中很普遍(Jung et al,2008)。丘脑区有脑血管意外的患者中,ED患病率更高(Jeon et al,2009)。
在患有脊髓损伤的男性中,损伤的性质、位置和严重程度在很大程度上决定了勃起功能。除ED外,这些男性可能伴有射精和性高潮功能受损,完全性脊髓上病变患者95%的保留反射性勃起,而在完全性脊髓下病变的患者中,只有25%保留了反射性勃起(Biering-Sørensen and Sønksen,2001)。骶副交感神经元在保留反射性勃起方面很重要,尽管胸腰段可能通过突触连接来弥补骶段的缺失。在这些患者中,轻微的触觉刺激可以触发勃起,尽管勃起时间较短并且需要持续的刺激。脊髓水平的其他疾病(例如脊柱裂、椎间盘突出、脊髓空洞、肿瘤、横纹肌炎和多发性硬化症),也可能以类似的方式影响传入或传出神经通路。
由于海绵体神经与盆腔器官的密切关系,盆腔手术后医源性ED的发生率很高,前列腺根治术后发生ED概率43%~100%(Walsh and Donker,1982;Borchers et al,2006),直肠癌腹会阴联合切除术后发生ED的概率为15%~100%(Weinstein and Roberts,1977)。
由于对盆腔神经和海绵体神经的神经解剖有了进一步的了解,因此对直肠、膀胱和前列腺癌进行了改良手术,从而降低了医源性ED的发生率。例如,保留神经的方法使前列腺根治术后ED的发生率降低到30%~50%(Catalona and Bigg,1990;Quinlan et al,1991),而直肠根治术后的ED发生率则不到10%(Liang et al,2008)。
在骨盆骨折的病例中,ED可能是海绵体神经损伤或血管功能不全或两者兼有的结果。在男性后尿道损伤患者中,早期尿道吻合术与延迟吻合术相比,前者保留勃起功能效果更好(ED率为34%,而后者为42%)(Mouraviev et al,2005)。在糖尿病患者中,神经源性和内皮依赖性舒张功能的损害导致NO释放不足(Saenz de Tejada et al,1989a)。由于不能直接检测自主神经功能,临床医师在诊断神经性ED时应谨慎。研究人员已经研制并改进了海绵体肌电图仪,用于诊断各种影响阴茎的疾病(包括自主神经病变),但该装置的临床应用仍在实践中(Guiliano and Rowland,2013)。
Rowland及其同事(1993)也报道说,随着年龄的增长,阴茎触觉敏感度下降。生殖器官的感觉信号对于觉醒和维持反射性勃起至关重要,当老年人逐渐失去心理性勃起时,这种感觉信号就变得更加重要。不管ED患者有或没有明显神经功能障碍,感觉评估都应该是ED评估的一个组成部分。
3.内分泌性ED
性腺功能减退症是ED患者的常见疾病。雄激素影响雄性生殖系统的生长发育和第二性征的维持,并已经证实了其对性欲和性行为的影响。Mulligan和Schmitt(1993)在对1975-1992年发表的文章进行回顾时得出结论:睾酮可提高性欲;增加性行为的频率;增加夜间勃起的频率,但对幻想诱导或视觉刺激的勃起几乎没有影响。Granata和他的同事(1997)报道说,正常夜间勃起的睾酮阈值约为200ng/dl。在对波士顿人口进行的一项观察性调查中,Araujo及其同事(2007)报道称,30-79岁的男性有症状性雄激素缺乏患病率为5.6%,老年男性的患病率更高,症状主要表现为低性欲(12%)、ED(16%)、骨质疏松及骨折(1%),两个或两个以上非特异性症状(20%)。然而,许多睾酮水平较低的男性是无症状的。在一项针对ED患者的研究中,Köhler及其同事(2008)的研究发现,47%的男性睾酮水平低于200ng/dl,33%的男性低于300ng/dl,23%的男性低于346ng/dl,7%的男性低于400ng/dl。年龄、未控制的糖尿病、高胆固醇和贫血都与男性ED患者睾酮水平显著下降有关。该团队的另一份报告中,腰围被认为是低睾酮和症状性雄激素缺乏最重要的预测因子(Hall et al,2008)。体重指数(BMI)在30kg/m2以上的男性中,总睾酮低于正常者占57.5%,游离睾酮低于正常者占35.6%。这些人中的大多数都患有低促性腺激素性性腺功能减退症(Hofstra et al,2008)。Traish和他的同事(2009)在一份全面的文献综述中指出,男性糖尿病患者发生空腹胰岛素、血糖及血红蛋白A1c值升高之前,他们的睾酮水平较低,表明性腺功能低下可能是糖尿病发展的前哨事件。这提示雄激素缺乏与胰岛素抵抗、2型糖尿病、代谢综合征及内脏脂肪沉积增多有关。内脏脂肪可作为内分泌器官,产生炎性细胞因子、诱发内皮功能障碍和血管病变。
雄激素的作用机制已被广泛研究过。Beyer和González-Mariscal(1994)报道,在交配时,睾酮和双氢睾酮(DHT)负责男性性活动,雌二醇或睾酮负责女性性活动。雄激素对血管内皮细胞和平滑肌细胞有良好的作用:雄激素促进内皮细胞增殖、降低血管内皮细胞炎症标志物的表达、抑制血管平滑肌细胞的增殖和内膜迁移。低雄激素水平与内皮细胞凋亡和平滑肌细胞凋亡有关。低雄激素水平还损害内皮祖细胞的增殖、迁移和归巢,以及间充质祖细胞向平滑肌分化(Mirone et al,2009;Traish and Galoosian,2013)。睾酮和DHT也可通过其非基因组效应舒张阴茎动脉和海绵体平滑肌(Waldkirch et al,2008)。在大鼠中,去势可减少动脉血流,引起静脉漏,并减少约50%的对海绵体神经刺激后的勃起反应(Mills et al,1994;Penson et al,1996)。去势还能提高阴茎平滑肌的α-肾上腺素能反应(Traish et al,1999)。研究称,临床上许多长期抗雄激素治疗的前列腺癌患者常发生性欲低下和ED。
下丘脑-垂体轴的任何功能障碍都会导致性腺功能低下。低促性腺激素性腺功能减退症可能是先天性的,也可能是由肿瘤或损伤引起的。高促性腺激素性腺功能减退可能由肿瘤、损伤、手术或腮腺炎引起。
高催乳素血症,无论是继发于垂体腺瘤还是药物,都会导致生殖和性功能障碍。症状包括性欲丧失、ED、溢乳、乳腺增生和不育。高催乳素血症与低血睾酮水平有关,可能是由于催乳素水平升高而抑制促性腺激素释放激素分泌所致(Leonard et al,1989)。在一项关于性功能障碍问卷研究中,催乳素水平与代谢综合征和动脉性ED,以及早泄和焦虑症状有关(Corona et al,2009)。
ED也可能与甲状腺功能亢进(甲亢)和甲状腺功能减退(甲减)有关。甲亢通常与性欲减退有关(这可能是由雌激素水平增加引起的),但甲亢同ED无明显关系。在甲减症中,睾酮分泌低下和催乳素水平升高是导致ED的原因之一。
4.动脉性ED
海绵体螺旋动脉粥样硬化或创伤性动脉闭塞病变可降低灌注压和减少海绵窦腔内的血流,延长达到勃起的时间,降低勃起的硬度。在大多数动脉性ED患者中,阴茎灌注受损是动脉粥样硬化过程的一个组成部分。与动脉性闭塞有关的常见危险因素包括高血压、高脂血症、吸烟、糖尿病、会阴或盆腔钝伤和盆腔放疗(Feldman et al,1994;Martín-Morales et al,2001)。Shabgh及其同事(1991)报道表明,随着ED危险因素的增加,发现阴茎血管异常的概率明显增加。动脉造影显示,动脉粥样硬化性ED患者存在阴部内动脉、阴茎动脉及海绵体动脉的双侧弥散性病变。阴茎或海绵体动脉的局灶性狭窄最常见于患有钝性盆腔损伤或会阴损伤的年轻患者(Levine et al,1990)。长距离骑行也是血管性和神经性ED的危险因素。骑行对会阴压迫导致的血管、内皮和神经源性功能障碍与ED的发生有密切关系(Sommer et al,2010)。然而,日常自行车出行的男性并不经常发生ED(Kim et al,2011)。
ED和心血管疾病有相同的危险因素,如高血压、糖尿病、高胆固醇血症和吸烟(Feldman et al,1994;Martín-Morales et al,2001)。阴部动脉病变在ED患者中比在同龄人群中更为常见。ED的自然缓解和病情进展在ED患者中发生的数量相当。BMI与ED缓解和进展的关系,以及吸烟和健康状况与进展的关系提示了通过生活方式干预促进缓解和延缓进展的潜在途径(Travison et al,2007)。
(1)心血管疾病:有冠心病、脑血管病和外周血管疾病的男性ED患病率较高(Bener et al,2008;Chai et al,2009),在冠心病患者中,ED患病率随冠状动脉病变程度的增加而增加(Montorsi et al,2006)。几项研究报道了ED与心血管疾病之间的联系。两者之间的联系可能由于雄激素、慢性炎症和心血管危险因素之间的相互作用,这些因素导致了内皮功能障碍和动脉粥样硬化,最终造成阴茎和冠状动脉功能紊乱。由于阴茎动脉的管腔比冠状动脉小,同样程度的内皮功能障碍导致阴茎组织中的血流量比冠状动脉循环中的血流量明显减少。ED可能是全身血管内皮功能障碍的一个指标(Gandaglia et al,2014)。在患有ED的慢性冠心病患者中,93%的患者在冠心病发病前发生了性功能障碍,平均时间间隔为24个月(范围为12~36个月)(Montorsi et al,2006)。这些数据促使一些研究人员提倡筛查ED,以此作为筛查男性是否有心血管疾病风险的一种手段(Gandaglia et al,2014)。
(2)高脂血症:ED与高脂血症和冠心病的高发率有关(Roumeguere et al,2003)。在Rancho Bernardo研究中的570例男性患者中,高胆固醇血症是25年后ED的预测因素。对波士顿地区1899名30-79岁男性的调查显示,未干预的高脂血症与ED无关联(Hall et al,2009)。
研究人员在不同的实验模型中,研究了高胆固醇血症对勃起功能的影响。在高胆固醇血症的兔模型中,海绵体超微结构检查显示窦腔出现早期动脉粥样硬化病变(Kim et al,1994)。虽然内皮细胞NO/cGMP通路受损,但神经性血管舒张功能未受影响(Azadzoi et al,1998)。NO/c GMP通路受损可能是由于超氧化物产生增加或内源性一氧化氮合酶抑制剂(如NG-单甲基-L-精氨酸单乙酸酯和不对称二甲基精氨酸)所致(Kim et al,1997)。补充L-精氨酸可以逆转内皮依赖性舒张功能损害(Azadzoi et al,1998)。血管内皮生长因子(VEGF)是维持内皮正常功能的重要血管生成因子。Ryu及其同事(2006)报道,大鼠食用4%胆固醇食物3个月后,其组织中VEGF和VEGF受体2显著下降。Xie和他的同事(2005)研究发现,家兔喂食1%胆固醇饲料后,当出现内皮依赖性舒张功能受损时,其组织的VEGF 的m RNA水平降低。
在进一步的缺血实验模型中,家兔首先接受髂动脉去内皮化,然后进行高胆固醇饮食(Azadzoi et al,1992)。由于海绵体平滑肌舒张能力下降,家兔出现阴茎动脉供血不足和静脉闭塞等功能障碍(Azadzoi et al,1997;Nehra et al,1998)。髂动脉和阴茎血管的变化与NOS活性降低、内皮依赖性和神经性NO介导的海绵体组织舒张功能下降有关(Azadzoi et al,1999)。由于NO活性受损,收缩性血栓素和前列腺素的产生增加,导致海绵体平滑肌神经源性收缩增强(Azadzoi et al,1998,1999)。
在大动脉中,氧化的低密度脂蛋白抑制内皮依赖性NO介导的舒张(Murohara et al,1994)。AHN和同事也报道了氧化的低密度脂蛋白增强海绵体平滑肌收缩能力。
(3)肥胖:在美国对65岁及以上社区男性的一项研究中,Garimella和Associates(2013)报道说,完成MMAS量表的男性中完全性ED的患病率为42%(4108例)。在完成国际勃起功能指数(IIEF-5)问卷(1659例)的性活跃男性中,中重度ED患病率为56%。在多因素调整的分析中,高体重、体重指数和总体脂百分比都与中度至重度和完全性ED的患病率有关。
血管周围脂肪组织(PVAT)被认为可以加强血管功能。PVAT中含有的脂肪细胞和基质细胞可分泌一些因子,通过旁分泌调节平滑肌和内皮细胞,包括脂肪因子、细胞因子、活性氧和气体化合物。在肥胖和糖尿病中,PVAT的扩张会导致血管胰岛素抵抗。PVAT衍生的细胞因子可能是影响动脉粥样硬化形成的关键因素。在高血压病中,PVAT的生理性抗收缩作用明显减弱。最重要的是,所有PVAT功能障碍的共同前提是免疫细胞浸润,它触发随后的炎症、氧化应激和低氧状态,造成血管功能障碍(Szasz et al,2013)。
(4)高血压:高血压是ED的独立危险因素(Feldman et al,1994;Johannes et al,2000),其心血管并发症如缺血性心脏病和肾功能衰竭都与ED的高发生率相关(Feldman et al,1994;Kaufman et al,1994;Johannes et al,2000)。然而,在高血压中,血压升高本身并不损害勃起功能;相反,相应的动脉生理和结构变化被认为是造成ED的原因(Hsieh et al,1989;Behr-Roussel et al,2005)。在来自美国护理数据库的两项分析中,ED患者和非ED人群中高血压患病率分别为41.2%和19.2%,其中包括了超过27万例ED男性(Seftel et al,2004;Sun and Swindle,2005)。
高血压男性是否罹患ED的潜在因素包括年龄大、病程长、高血压的严重程度和降压药物的使用等(Doumas et al,2006)。动脉性高血压的特点是血管张力改变及血管收缩能力增加,同时伴随着血管平滑肌细胞的增殖、迁移和动脉壁不同程度的炎症。Rho激酶通路在动脉血压调节中起着重要的作用(Nunes et al,2010)。内皮功能障碍、氧化应激和自身免疫性疾病也是动脉疾病和ED的潜在原因。随着损伤因子的释放,血管细胞上的Toll样受体激活,这种激活对炎症、血管反应性和血管重塑性的影响被认为是炎症与高血压之间的一种新的联系(McCarthy et al,2014)。此外,内质网应激反应导致主动脉内皮依赖性收缩被认为是自发性高血压大鼠(SHR)模型罹患高血压的原因之一(Spitler et al,2013)。高血压大鼠血管紧张素Ⅱ介导的还原型烟酰胺腺嘌呤磷酸氧化酶活性升高可能是超氧阴离子增多的原因(Jin et al,2008)。
(5)血管性勃起功能障碍的机制
①结构改变:在动脉性ED中,阴茎海绵体血氧分压低于心理性ED(Tarhan et al,1997),PGE1和PGE2的形成是氧依赖性的,在家兔和人阴茎海绵体中,前列腺素E2升高和转化生长因子-β1诱导的胶原合成都与氧分压升高有关(Moreland et al,1995;Nehra et al,1999),氧分压降低可能会减少海绵体小梁平滑肌的含量,导致弥散性静脉渗漏(Saenz de Tejada et al,1991b;Nehra et al,1998)。
动脉管腔狭窄或管壁/管腔比值增加会导致高血压患者外周血管阻力的增加。在SHR的阴茎血管中也出现阻力增加,这种改变归因于动脉和勃起组织的结构改变(Gradin et al,2006;Arribas et al,2008)。SHR已经证实了有线粒体损伤(在平滑肌和内皮细胞)和神经退化。当大鼠接受1型血管紧张素Ⅱ受体(AT1)阻滞剂、AT 1阻滞剂与PDE5抑制剂,以及选择性β1受体阻滞剂奈比洛尔治疗时,可以部分地预防或逆转结构改变(Mazza et al,2006;Toblli et al,2006a,2006b)。
②平滑肌收缩和血管收缩的增强:在动物模型中,RhoA/Rho激酶活性的增加导致海绵体平滑肌收缩能力的增强,会增加糖尿病(Bivalacqua et al,2004)、高胆固醇血症(Morikage et al,2006)、高血压(Fibbi et al,2008)、性腺低下(Vignozzi et al,2007)和年老患者(Jin et al,2006;Andersson,2011)发生ED的概率。Park及其同事(2006)发现,Rho/Rho激酶通路主要参与ED和盆腔动脉粥样硬化的病情进展,长期使用Rho激酶抑制剂法舒地尔可以预防这两种疾病。
动脉粥样硬化、高血压、高胆固醇血症患者血内的内皮素-1水平升高,器质性ED患者静脉血和海绵体血内的内皮素-1水平也较高(Nohria et al,2003;El Melegy et al,2005)。尽管如此,有研究使用内皮素-A受体拮抗剂治疗ED并没有产生良好的效果(Kim et al,2002),AT 1受体拮抗剂和血管紧张素转换酶(ACE)抑制剂分别在治疗ED和高血压的男性,以及患有ED和动脉粥样硬化的男性中显示出了良好的应用前景(Speel et al,2005;Baumhäkel et al,2008)。
③内皮依赖性平滑肌舒张功能受损:内皮功能障碍被认为是心血管疾病与ED的共同点(Brunner et al,2005)。据报道,ED患者肱动脉内皮依赖性血流介导的舒张功能受损,其受损程度与ED的严重程度有关(Kovacs et al,2008)。然而,一种用于评估阴茎内皮依赖性血管舒张功能的血管造影装置未能发现男性ED患者肱动脉与阴茎动脉的相关性(Vardi et al,2009)。
内皮祖细胞是在骨髓中产生的具有再生能力的细胞,迁移到外周血管以修复内皮缺损。内皮祖细胞的数量在ED患者和冠心病患者以及肥胖男性中减少(Foresta et al,2005;Baumhäkel et al,2006;Esposito et al,2009)。短期和长期服用PDE5抑制剂可增加循环内皮祖细胞的数量,改善内皮和勃起功能(Foresta et al,2005,2009)。
在SHR中,乙酰胆碱的舒张作用在海绵体内减弱(Behr-Roussel et al,2003)。SHR血管内皮依赖性舒张功能受损可归因于血管紧张素Ⅱ(Rajagopalan et al,1996)、血栓素和超氧化物(Cosentino et al,1998)或高血压等(Paniagua et al,2000)(表6-10)。
表6-10 导致勃起功能障碍的血管改变及结构改变
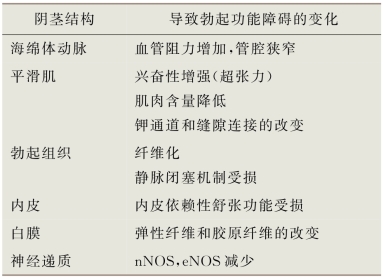
e NOS.内皮一氧化氮合酶;n NOS.神经元一氧化氮合酶
5.海绵体性(静脉性)ED
静脉关闭障碍被认为是血管源性ED最常见的原因之一,静脉闭塞功能障碍可能是多种病理生理过程所致(Rajfer et al,1988),包括白膜退行性改变、纤维弹性结构改变、小梁平滑肌舒张不足和静脉分流。
退行性改变(如阴茎硬结症、年老和糖尿病)或创伤损伤的白膜(如阴茎折断)可损害白膜下静脉和导静脉的压迫(Gonzalez-Cadavid,2009),在阴茎硬结症中,无弹性的白膜可能阻碍导静脉关闭(Metz et al,1983)。Chiang和他的同事(1992)认为,白膜弹性纤维的减少和白膜微结构的改变可能导致某些男性ED。白膜下层组织的改变可能会影响静脉闭塞机制,在阴茎硬结症手术后偶尔可见(Dalkin and Carter,1991)。
海绵体小梁、平滑肌和内皮纤维弹性成分的结构改变可能导致静脉渗漏。不充分的小梁平滑肌松弛,导致海绵窦不充分扩张及小静脉的不充分压迫,这可见于肾上腺素能亢进或神经递质释放不足的患者。这些患者常伴有焦虑症状。研究表明,α肾上腺素能受体的改变或NO释放的减少,可能会增加平滑肌张力及减弱对内源性肌松药的舒张反应(Christ et al,1990)。
获得性静脉分流——手术治疗阴茎异常勃起,可能导致持续性阴茎头/阴茎海绵体或阴茎海绵体/尿道海绵体分流。
(1)弹性纤维成分:在存在糖尿病、高胆固醇血症、血管疾病、阴茎损伤或年老等因素的患者中,可见阴茎海绵窦顺应性丧失、胶原沉积增多、弹性纤维减少。Sattar及其同事(1994)研究发现,阴茎弹性纤维平均百分比在不同人群中差异显著:正常男性9%,静脉渗漏5.1%,动脉疾病4.3%。在血管源性ED动物模型中,Nehra及其同事(1998)证明,海绵体舒张能力与平滑肌含量相关,可用于小梁组织学预测。PGE1通过TGFβ1抑制人海绵体平滑肌胶原合成,提示海绵体内注射前列腺素E1可能有助于预防海绵体纤维化。
(2)平滑肌:由于海绵体平滑肌控制着勃起的血管,所以平滑肌含量和超微结构的改变可能会影响勃起反应。Sattar及其同事(1996)在一项对人阴茎组织的研究中,表明正常男性阴茎海绵体平滑肌(肌间蛋白38.5%或肌动蛋白45.2%)的百分比与静脉组(肌间蛋白27.4%;肌动蛋白34.2%)或动脉组(肌间蛋白23.7%;肌动蛋白28.9%)之间存在显著差异。一项体外生化研究表明,糖尿病ED患者阴茎平滑肌的神经和内皮相关舒张功能受损(Saenz de Tejada et al,1989a),在血管性和神经性ED中,受损的平滑肌可能是加重原发病因的关键因素(Mersdorf et al,1991)。Pickard和他的同事(1994)的研究显示,在静脉或混合静脉/动脉闭塞患者中,神经诱发的舒张功能和α肾上腺素刺激海绵体平滑肌收缩功能受损。
离子通道与肌肉功能密切相关。Fan和他的同事(1995)报道了ED患者细胞中Maxi-K通道的改变,认为这可能是导致ED患者细胞膜超极化能力降低、钙稳态改变和平滑肌舒张受损的原因之一。在动物研究中,Jünemann及其同事(1991)发现,在喂食高胆固醇饮食3个月的家兔中,平滑肌变性明显,细胞与细胞失去联系。在兔的血管源性ED模型中,Azadzoi及其同事(1997)证明了海绵体缺血可导致静脉闭塞性功能障碍。海绵体神经损伤也可能影响海绵体平滑肌舒张,这在狗的模型中也得到了证实(Paick et al,1991)。
①缝隙连接:缝隙连接是细胞间的通信通道,负责勃起反应的同步和协调(Christ et al,1991)。在严重动脉疾病中,细胞膜间胶原纤维减少,细胞之间的联系减弱。Suadicani及其同事(2009)报道,在老年和链霉素诱导的糖尿病大鼠模型中,其阴茎海绵体缝隙连接蛋白43显著减少。
②内皮:内皮不仅是NO的重要来源,也是许多其他信号分子的重要来源,包括EDHF、PGI2和过氧化氢,此外,内皮通过转运的化学递质(如NO和PGI2)和(或)通过肌内皮缝隙连接的低阻电偶联,调节血流介导血管扩张,并影响有丝分裂活性、血小板聚集和中性粒细胞黏附。血管内皮功能的受损是血管疾病发展的早期指标(Triggle et al,2012),糖尿病和高胆固醇血症改变了内皮介导的海绵体平滑肌舒张功能,进而损害勃起功能(Azadzoi et al,1991)。在一项高胆固醇血症小鼠细胞连接蛋白的研究中,Ryu及其同事(2013)报道了内皮特异性c细胞连接蛋白,包括claudin-5、血管内皮细胞-cadherin和血小板内皮细胞黏附分子1的下调,以及内皮细胞含量降低,可能与ED有关。
③结构完整性:SH H是哺乳动物刺猬基因家族的三种蛋白之一,另外两种蛋白为desert hedgehog和Indian hedgehog。SHH在调节脊椎动物的器官发育中起着关键作用,例如四肢手指和大脑组织。同时SHH对人类也有重要作用,它控制着机体干细胞的细胞分裂,并参与了一些癌症的发生发展。SHH通过接收来自海绵体的神经信号,进而调节海绵体平滑肌的凋亡。在神经性ED动物模型中,给予阴茎SHH蛋白治疗能够阻止海绵体神经诱导的细胞凋亡和结构改变(Podlasek,2009)。
④勃起功能标志:多样性的编码序列蛋白A1(Vcsa1)被认为是大鼠勃起功能的标志。Vcsa 1在神经源性、糖尿病和老年ED动物模型中的表达下调。Vcsa蛋白产物sialorphin是内源性中性内切肽酶抑制剂。在人类中,Vcsa1基因至少有3个同源基因(hSMR3A,hSMR3B和PROL1)。据报道,hSMR3A的基因表达在ED患者中下调(Davies and Melman,2008)。
各种心血管危险因素与ED的发病和严重程度相关,其中包括内皮功能、血栓形成和血脂异常的标记物。这些标记物可用作ED患者的心脏代谢风险指标。尽管NO、ADMA、内皮素和遗传多态性的生化指标在心血管疾病和ED具有一定的临床应用前景,但仍在研究中(Lippi et al,2012)。
6.药物性
ED在老年男性中很常见,并且不可避免地与其他疾病并存,这些疾病本身就是导致ED的危险因素,例如抑郁症、糖尿病和心血管疾病(Feldman et al,1994)。此外,与药物有关的性症状可能和欲望、性唤醒和性高潮的多种性行为相关,而不仅限于功能受损。应谨慎地解读药物不良反应表现为ED的自我报告和问卷数据。
(1)抗高血压药:几乎所有的抗高血压药都将ED列为潜在的不良反应。然而,最新的临床对照试验澄清了一些误区。
①利尿药:噻嗪类利尿药是一种碳酸酐酶抑制剂,可碱化微环境并引起血管扩张。噻嗪类利尿药的主要活性是抑制肾远曲小管直接偶联的Na-Cl协同转运体。实际上,当由于氯化钠的消耗而发生细胞外液体积减少时,心输出量趋于下降,导致反应性血管收缩。然而,长期来看,心输出量的调节取决于机体新陈代谢的需要和血管舒张功能,通过调节使心输出量回到基线水平;这促使低血容量低血压转变为血管舒张性低血压(Ellison et al,2009)。
噻嗪类利尿药已得到广泛研究。来自英国的一项大型试验的数据显示,服用噻嗪类利尿药治疗轻度高血压的男性患者发生ED的数量是服用普萘洛尔或安慰剂的男性患者的2倍——这也是苄氟噻嗪研究退组的最常见原因。
在治疗轻度高血压的研究中也发现了类似的结果,该研究中显示,2年内服用低剂量噻嗪类利尿药的男性ED的患病率是服用安慰剂或替代药物的男性的2倍(Grimm et al,1997)。然而经过4年的治疗后,安慰剂组ED的患病率趋于或接近噻嗪类组,这一发现并未完全被研究者所解释。这可能是噻嗪类药物并不能直接引起ED,而是促使ED早期阶段表现出来。一项比较噻嗪类利尿药、安慰剂或阿替洛尔对高血压患者性功能研究也发现,噻嗪类组患者ED的发生率较高,但这可通过减轻体重得到改善(Wassertheil-Smoller et al,1991)。但是,利尿药诱发ED的机制尚待阐明。
②β-肾上腺素受体拮抗剂:受体研究表明,阴茎组织中只有10%的肾上腺素能受体是β型的,它们兴奋后的作用是介导舒张(Andersson and Wagner,1995)。这种反应在体外可被非选择性药物如普萘洛尔所抵抗,而不能被心脏选择性药物如普拉洛尔所减弱(Srilatha et al,1999),其可能主要是通过β2受体发挥作用。β受体拮抗剂在中枢神经系统内也发挥着抑制作用,并可能导致性激素水平的下降(Suzuki et al,1988)。
β-肾上腺素受体拮抗剂对勃起功能的不同作用取决于它们是普通拮抗剂、选择性拮抗剂还是具有血管舒张功能的药物。非选择性药物如普萘洛尔与安慰剂或ACE抑制剂治疗相比(Croog et al,1986),其ED患病率相比更高。随后使用β1肾上腺素能受体选择性较高的药物,如乙酰丁醇,结果显示ED发病明显减少,安慰剂组和ACE抑制剂组之间没有差异(Grimm et al,1997)。卡维地洛是一种普通的β-肾上腺素受体拮抗剂,它也可通过阻断α1肾上腺素能受体而引起血管舒张,与ED加重有关(Fogari et al,2001)。最近引进的一些β1-肾上腺素受体拮抗剂,如奈比洛尔,具有通过释放NO介导的血管舒张作用(Reidenbach et al,2007)。在与选择性β1-肾上腺素受体拮抗剂美托洛尔和阿替洛尔的交叉研究中,奈比洛尔没有降低高血压男性患者的性功能,在某些情况下反而对勃起功能有促进的作用(Boydak et al,2005;Brixius et al,2007)。
③α-肾上腺素受体阻滞剂:动物研究表明,α受体阻滞剂,特别是对α1受体起作用的拮抗剂可通过增加或延长海绵体平滑肌的舒张反应来促进勃起(Andersson and Wagner,1995),此外,α2受体的激活还对去甲肾上腺素的释放起调节作用,提示α2受体阻滞剂可能具有舒张海绵体平滑肌的作用。在临床观察中,用于治疗高血压(Grimm et al,1997)或减少泌尿道症状(Flack,2002)的多沙唑嗪类药物与ED的发病无关,且发生率低于安慰剂组。α2受体激动剂,如可乐定,通过外周和中枢机制导致勃起功能减弱(Srilatha et al,1999)。甲基多巴是一种中枢作用药物,它可能通过拮抗下丘脑α2受体发挥作用(Croog et al,1988),它与安慰剂和其他降压药物相比证实了其与ED发病有关。
④血管紧张素转换酶抑制剂:ACE抑制剂没有明显的外周或中枢效应,不会干扰性功能。体内实验表明,ACE抑制剂卡托普利对清醒正常血压大鼠的性功能无明显不良影响(Srilatha et al,1999)。在三项高血压治疗的临床研究中,将ACE抑制剂与其他药物和安慰剂进行比较,发现ACE抑制剂与安慰剂相比无差异,与其他药物相比,性功能得到改善(Croog et al,1988;Suzuki et al,1988;Grimm et al,1997)。
⑤血管紧张素Ⅱ1型受体拮抗剂:在高血压或衰老的正常血压动物的研究中,AT 1受体拮抗剂逆转阴茎血管的结构变化,可能起保护勃起功能的作用(Hale et al,2001,2002;Park et al,2005;Hannan et al,2006)。在临床横向研究中,AT 1受体拮抗剂与其他抗高血压药物相比,有改善勃起功能的可能(Doumas et al,2006)。在一项交叉研究中,缬沙坦与β-肾上腺素受体拮抗剂卡维地洛进行比较,缬沙坦对先前存在的性功能障碍有良好的治疗作用,在治疗12个月期间无不良性影响(Fogari et al,2001)。据报道,氯沙坦治疗3个月也可改善性功能(Llisterri et al,2001)。
⑥钙离子通道阻滞剂:临床研究证实钙离子通道阻滞剂没有影响勃起功能的不良反应;射精方面的影响可能与降低了球海绵体肌的收缩力有关,持续时间较短(Suzuki,1988),在TOMHS研究中,与安慰剂组相比,氨氯地平组的ED患病率没有增加(Grimm et al,1997)。另一项研究也表明,在使用假阳性治疗高血压或与ACE抑制剂联合治疗时,ED的患病率并没有增加(Cushman et al,1998)。(https://www.daowen.com)
⑦醛固酮受体拮抗剂:螺内酯和依普利酮是盐皮质激素阻断药,用于阻止醛固酮的上皮性和非上皮性作用。螺内酯是一种非选择性的盐皮质激素受体对抗药,对黄体酮和雄激素受体具有适度的亲和力。后一种特性增加了内分泌不良反应的可能性,包括性欲丧失、男性乳房发育和勃起功能障碍。依普利酮是一种下一代的醛固酮受体对抗药,仅针对醛固酮受体,它对黄体酮和雄激素受体的影响更小(Sica,2005)。
⑧总结:轻中度高血压的治疗药物的不良反应应控制在可接受状态,以增加顺从性。噻嗪类利尿药具有较高的ED发病率,但可以通过联合治疗和减轻体重而使之降低。α1受体阻滞剂和血管紧张素Ⅱ受体阻滞剂可改善性功能,因此,在治疗前即存在ED的患者应用这类药物是有益的(Khan,2002)(表6-11)。
表6-11 抗高血压药物对性功能的影响

(2)抗精神药物:和高血压一样,潜在的疾病可能比药物更与ED相关。然而,中枢神经系统内受体的复杂性和通路的相互关系使参与性功能的神经元和神经节极有可能受到精神药物的影响,从而导致正面或负面的功能改变。例如,精神分裂症患者的性欲望丧失,而服用抗精神病药物的患者表现出更大的欲望,但出现勃起功能和射精障碍(Aizenberg et al,1995)。
①抗精神病药:这一类药物对中枢神经系统受体有很多作用,也可有外周性作用。它们的治疗效果被认为与大脑边缘系统和额前部区域的多巴胺能受体的阻滞有关。他们的不良反应与β肾上腺素能受体阻滞和抗胆碱能作用有关,与在基底节的抗多巴胺能受体作用一样,引起锥体外系的不良反应,通常会产生性功能方面的症状(Sullivan and Lukoff,1990)
锥体外系反应的发生可以区别典型的老一代抗精神病药物(性功能症状较频繁)和新一代不典型的抗精神病药物(性功能症状不常见)。这种差别可能与对特定种类受体的亲和力(Strange,2001)或大脑皮质特定区域的(Westerink,2002)亲和力有关。多巴胺能受体阻滞的另一个效应高催乳素血症,也可通过减少大脑中枢的多巴胺释放改变性功能,这在老的典型抗精神病药物较常见(Smith and Talbert,1986)。
动物实验表明,老鼠下丘脑MPOA区域的D1受体的激活通过中间催产素能神经元和脊髓胆碱能通路促进勃起。可能这些区域的D2受体激活具有相反的作用(Zarrindast et al,1992)。老一代抗精神病药物例如氟哌啶醇、三氟噻醇在实验动物中已经显示,通过D1受体的拮抗作用减少阿扑吗啡诱导的勃起(Andersson and Wagner,1995)。另外在兔子全身应用抗精神病药物通过局部多巴胺能作用产生勃起,可能是通过对其α1受体的拮抗作用(Naganuma et al,1993)。因此,抗精神病药物对性功能的临床作用根据他们对特定受体的亲和力不同而不同。
在一项抗精神病药物的非随机对照试验中,性功能障碍的发病率为40%~70%(Wirshing et al,2002)。新的药物如氯氮平对性欲降低的影响较轻,应用利哌酮的患者勃起频率下降幅度最大。
②抗抑郁药:对所有患者来说,应用抗抑郁药物对性功能的不良反应程度不同,但重要的是这关乎药物使用的依从性,因为这类药物经常在年轻患者和中年患者中应用。在一份关于15个随机试验的综述中,除了改变药物外,添加安非他酮或PDE5抑制剂对抗抑郁药物似乎是一种有效的方法来纠正抗抑郁药物相关的ED(Rudkin et al,2004)。
a.三环类抗抑郁药:该类药物通过抑制中枢神经系统中儿茶酚胺的再摄取而发挥作用。它们在性功能方面的不良反应被认为与外周抗胆碱能和β肾上腺素能效应有关,也可能拮抗5-羟色胺受体。临床对照研究表明,该类药物常引起两性的性高潮紊乱常见,说明这些药物可作为射精的抑制剂应用(Harrison et al,1986;Monteiro et al,1987)。
b.单胺氧化酶抑制剂:在对照研究中发生性高潮障碍的概率较高(Harrison et al,1986),但是其中枢性和外周性的作用机制还不确定。
c.选择性血清素再摄取抑制剂(SSRIs):是目前常用的一类治疗抑郁症的药物。它们抑制了5-羟色胺被中枢神经系统神经元再摄取,因此产生对不同5-羟色胺能受体的刺激作用。据估计,近50%的应用这些药物的患者出现性功能变化(Rosen et al,1999;Keltner et al,2002)。可能的机制包括对5-HT 2和5-HT 3受体的抑制,从而抑制脊髓勃起通路(Tang et al,1998)、MPOA的多巴胺释放减少(Maeda et al,1994)、对NOS的抑制,以及降低黄体生成素、卵泡刺激素、睾酮的血清水平。临床对照研究表明,性功能的改善是由于抑郁症状的减轻,与之相比其他的不良反应就不重要了(Michelson et al,2001)。然而,另一项安慰剂随机对照研究显示,在选择性血清素再摄取抑制剂治疗组,性功能障碍发生率增加(Labbate et al,1998;Croft et al,1999)。进一步的研究表明,这些不良反应可以通过同时给予其他药物如西地那非(Fava et al,2006)或米安色林(Aizenberg et al,1997)而改善。
不同的选择性血清素再摄取抑制剂导致的ED的程度存在差异。应用帕罗西丁治疗的患者发病率较高(Kennedy et al,2000),西酞普兰影响最小(Mendels et al,1999)。这表明该类药物除抑制血清素的再摄取外,还有其他机制,这得到了一项关于急性或慢性帕罗西丁而非西酞普兰通过抑制NO产生引起老鼠发生ED的报道的支持(Angulo et al,2001b)。帕罗西丁对勃起功能的急性抑制效应,可以通过伐地那非对PDE5的抑制而得到预防(Angulo et al,2003a)。
③其他抗抑郁药:动物实验表明,刺激中枢神经系统内的5-HT 1受体可调节性功能,其中刺激5-HT 1 A可增加射精,刺激5-HT 1c亚型可促进勃起。最近开发的抗抑郁药,如米氮平和奈法唑酮,对性功能有益,可能是通过激活增加性反应的5-HT 1C受体实现(Stancampiano et al,1994),当然它们也可能是通过拮抗5-HT2C受体产生作用(Millan et al,2000)。一项关于曲唑酮引起的阴茎异常勃起的独立报道表明,可能与其主要代谢物间氯苯哌嗪所引起的5-HT1C致勃起效应有关(Andersson and Wagner,1995)。一项临床研究表明,曲唑酮减少了快速动眼睡眠,但能增加夜间勃起活动(Ware et al,1994)。
④抗焦虑药:先前认为抗焦虑药与ED无关,但MMAS的研究表明,抗焦虑药已经涉及性问题(Derby et al,2001)。苯二氮 类可增强GABA在网状和边缘系统中的作用,但它们也可能影响5-羟色胺和多巴胺能通路。实验研究表明,GABA能抑制多巴胺激动剂阿扑吗啡诱导的勃起(Zarrindast and Farahvash,1994)。一项对照临床研究表明,锂和苯二氮
类可增强GABA在网状和边缘系统中的作用,但它们也可能影响5-羟色胺和多巴胺能通路。实验研究表明,GABA能抑制多巴胺激动剂阿扑吗啡诱导的勃起(Zarrindast and Farahvash,1994)。一项对照临床研究表明,锂和苯二氮 类药物联合治疗引起的性功能障碍发生率明显高于单用锂治疗(Ghadirian et al,1992)。最近的一些抗焦虑药,如安非他酮主要抑制多巴胺的再摄取,丁螺环酮主要作用于5-HT 1A受体,在以安慰剂为对照组的试验中未发现其不良反应与性功能有关(Coleman et al,2001),并且这些抗焦虑药可以用于缓解由其他抗抑郁药引起的性症状(Gitlin et al,2002)。
类药物联合治疗引起的性功能障碍发生率明显高于单用锂治疗(Ghadirian et al,1992)。最近的一些抗焦虑药,如安非他酮主要抑制多巴胺的再摄取,丁螺环酮主要作用于5-HT 1A受体,在以安慰剂为对照组的试验中未发现其不良反应与性功能有关(Coleman et al,2001),并且这些抗焦虑药可以用于缓解由其他抗抑郁药引起的性症状(Gitlin et al,2002)。
⑤抗痉挛药:癫 放电可能影响下丘脑-垂体轴的功能和对性功能重要的激素水平(Morris and Vanderkolk,2005),服用拉莫三嗪的癫
放电可能影响下丘脑-垂体轴的功能和对性功能重要的激素水平(Morris and Vanderkolk,2005),服用拉莫三嗪的癫 患者在性功能、生物活性睾酮水平和性腺功能等方面与对照组和未治疗组水平相当,但显著高于使用卡马西平或苯妥英治疗的男性患者(Herzog et al,2004)。性高潮障碍在接受卡马西平治疗的患者中很常见,在服用丙戊酸盐的男性中,性欲丧失也十分常见(Kuba et al,2006)。有报道称,使用拉莫三嗪治疗的患者性功能和性欲亢进症状得到了明显改善(Gil-Nagel et al,2006;Grabowska-Grzyb et al,2006)。
患者在性功能、生物活性睾酮水平和性腺功能等方面与对照组和未治疗组水平相当,但显著高于使用卡马西平或苯妥英治疗的男性患者(Herzog et al,2004)。性高潮障碍在接受卡马西平治疗的患者中很常见,在服用丙戊酸盐的男性中,性欲丧失也十分常见(Kuba et al,2006)。有报道称,使用拉莫三嗪治疗的患者性功能和性欲亢进症状得到了明显改善(Gil-Nagel et al,2006;Grabowska-Grzyb et al,2006)。
7.抗雄激素药物
雄激素是通过调节中枢神经系统内的雄激素受体来改变性行为。抗雄激素药物通过抑制雄激素的产生或拮抗雄激素受体而导致部分或几乎完全阻断雄激素的作用。雄激素缺乏对性功能的影响从完全丧失到不影响正常功能不等。一项关于人类的实验研究表明,在快速动眼睡眠期夜间勃起是雄激素依赖性的,而视觉性刺激下的勃起则是独立的(Andersson and Wagner,1995)。在动物实验中,去势降低了大鼠阴茎海绵体内一氧化氮合酶(NOS)的活性,导致勃起功能降低。睾酮可恢复NOS的活性,但非那雄胺可阻止这种恢复,提示DHT可能是阴茎组织中重要的雄激素(Lugg et al,1995)。
5α-还原酶抑制剂非那雄胺和度他雄胺是对雄激素循环影响最小的抗雄激素药物。一项以安慰剂为对照的随机研究表明,服用非那雄胺(每日5mg)治疗前列腺疾病的患者中有5%抱怨性欲下降和勃起功能障碍,而对照组为1%(Gormley et al,1992)。在使用低剂量(每天1mg)治疗男性脱发的患者中,未检测到性功能障碍。然而,有报道称停用非那雄胺治疗脱发后可出现持续数月至数年的性功能障碍(普罗法斯特,1mg)。其不良反应包括性欲降低、勃起功能障碍、性兴奋减少、性高潮困难等(Irwig and Kolukula,2011)。
通过对雄激素受体的竞争性拮抗可实现更完全的雄激素阻断,阻止睾酮和DHT的信号转导。非甾体类药物如氟他胺和比卡鲁胺对雄激素受体有相对特异性的阻断作用。甾体类抗雄激素环丙酮乙酸酯对下丘脑也有抑制作用。这些药物用于局部晚期和转移性前列腺癌的姑息治疗,可单独使用,也可与黄体生成素释放激素(LHRH)激动剂或拮抗剂联合使用。单独使用时,非甾体类抗雄激素与血清睾酮水平增加有关。当非甾体类抗雄激素与LHRH激动剂或拮抗剂联合使用时,可使睾酮降低至去势范围。主要不良反应是性欲降低,发生率高达70%(Iversen et al,2001)。
在一项样本量较大、持续时间较长的临床试验中,单用比卡鲁胺治疗的性欲下降幅度比去势更小(Iversen et al,2000)。然而,在另一项大型对照试验中,使用氟他胺或环丙肾上腺素治疗后,大约80%的患者在2~6年内逐渐失去性欲(Schroder et al,2000)。在一项以安慰剂为对照的研究中,接受比卡鲁胺疗法的患者中有一半患者勃起功能丧失,即使剂量已经低至50mg(Eri and Tveter,1994)。
药物去势与LHRH拮抗剂(立即抑制睾酮)或激动剂(睾酮最初激增)所引起的几乎完全的雄激素剥夺会导致性欲的严重丧失,而且通常伴随着ED(Basaria et al,2002)。在一项小型研究中,在开始治疗前后进行夜间阴茎勃起(NPT)监测为药物作用研究提供了客观的数据支持(Marumo et al,1999)。
8.其他药物
许多其他药物被认为在性功能方面有不良反应,特别是引起男性ED等,但这些争论通常是基于单病例报告或上市后药物警报而非对照试验。
(1)地高辛:在用离体人海绵体组织进行的体外实验中,地高辛减弱了其对乙酰胆碱和内在神经刺激的松弛反应;这与在视觉性刺激后服用安慰剂的男性中未检测到阴茎硬度降低有关(Gupta et al,1998)。一项随机的临床研究证实,血浆睾酮水平下降会引起性功能的降低(Neri et al,1987)。然而,其他研究人员并没有发现服用地高辛的男性在性激素和肾上腺激素水平上有明显变化(Kley et al,1984)。
(2)他汀类药物:他汀类药物用于降低血脂水平,在可能存在性功能障碍的男性中普遍使用,尤其是ED。在一项安慰剂对照试验中,服用他汀类药物的男性虽然高脂血症内皮功能障碍的指标有所改善,但是ED的发生率提高了1倍(12%∶6%)(Bruckert et al,1996)。在另一项研究中,93例男性参加了心血管风险诊疗,经过6个月的他汀治疗后,IIEF评分从21降低到6.5(0~25,P<0.001),同时22%的患者出现了新发ED。作者认为,由于年龄、吸烟和糖尿病等心血管危险因素所致的严重内皮功能障碍患者,经他汀类药物治疗后,ED发生率更高(Solomon et al,2006)。相比之下,在斯堪的纳维亚地区的辛伐他汀生存研究中,4444例冠心病患者被随机分配接受辛伐他汀或安慰剂治疗长达6年,在28例接受安慰剂治疗的患者和37例接受辛伐他汀治疗的患者中发现ED(Pedersen and Faergeman,1999)。在服用他汀类药物的男性中,出现ED的原因似乎是患者潜在的疾病,而不是药物本身。
关于性功能的不良反应,研究最多的他汀类药物是阿托伐他汀。据报道,在临床研究中,阿托伐他汀具有以下积极效果:①在治疗4个月的高脂血症患者中,夜间阴茎活动得到改善并且男性性健康问卷调查表的平均得分从14.2提高到20.7(Saltzman et al,2004);②与ACE抑制剂喹那普利联合应用时,对于确诊阴茎疾病的ED患者和对PDE抑制剂反应不佳的患者有积极作用(Bank et al,2006);③初始对西地那非无反应的ED患者对西地那非的反应改善(Herrmann et al,2006);④与西地那非合用时,使接受根治性前列腺切除术的男性的勃起功能恢复得到改善(Hong et al,2007);⑤对高脂血症患者随访12个月的IIEF问卷评分有积极影响(Dogru et al,2008)。
他汀类药物分为天然药物(洛伐他汀)、半合成药物(辛伐他汀)和合成药物(阿托伐他汀,西立伐他汀)而且具有结构异质性。他汀类药物可能对性功能有不同的影响,但仍有待阐明。
(3)组胺H 2受体拮抗剂:西咪替丁和雷尼替丁广泛用于预防和治疗消化性溃疡疾病。病例报告提示,西咪替丁与ED有关。一项体外动物研究表明,H 2受体刺激可能通过内皮释放NO导致海绵体松弛(Andersson and Wagner,1995)。
(4)阿片类药物:阿片类药物长期鞘内给药导致低促性腺激素、性腺功能减退和相关的性功能障碍,可以通过适当的补充来恢复(Abs et al,2000)。然而,通过NPT监测客观地测量到患者使用阿片类拮抗剂治疗老年男性勃起功能障碍并未发现改善勃起功能(Billington et al,1990)。阿片类药物直接作用于大鼠大脑MPOA时对性功能具有广泛的抑制作用,但用阿片受体拮抗剂纳洛酮治疗健康男性志愿者对性功能没有影响(Andersson and Wagner,1995)。
(5)抗反转录病毒药物:与年龄相近的普通美国男性相比,性腺功能减退和ED似乎在感染人类免疫缺陷病毒(HIV)的男性中更常见(Crum et al,2005)。在引入抗反转录病毒疗法后,性功能障碍似乎是一种常见事件,平均发病率为ED 46%;性欲下降44%;射精障碍39%和性高潮障碍27%(Collazos et al,2007)。这些紊乱在用蛋白酶抑制剂治疗的患者中似乎更常见。由于这些患者可能患有涉及多种器官系统的疾病,并且可能正在服用多种药物,因此确切的机制很难确定。
(6)烟草:由于其对海绵体平滑肌的收缩作用,吸烟可能引起血管收缩和阴茎静脉漏(Juenemann et al,1987a)。Hirshkowitz及其同事在1992年的一项NPT研究中报道,夜间勃起(硬度和持续时间)与每天吸烟数量之间存在负相关,每天吸烟超过40支的人有最弱和最短的夜间勃起。波士顿地区社区卫生(BACH)调查使用多阶段分层随机样本从波士顿招募2301名30-79岁的男性,作者的报道指出了吸烟与ED之间的剂量与反应关系,并且在每年吸烟20包或更多包的暴露中观察到统计学显著效应。被动吸烟与ED风险的小幅增加有关,但统计学无差异;与每年主动吸烟10~19包的影响相当(Kupelian et al,2007)。在阐明与烟草使用有关的ED的机制的实验中,将不含尼古丁和无焦油的香烟烟雾提取物每天一次皮下注射到成年雄性家兔中共5周,作者报道了海绵体组织中NOS活性减弱、n NOS蛋白下调、内源性NOS抑制剂的积累、精氨酸酶活性的增强,以及阴茎精氨酸酶Ⅰ蛋白的上调致使NO产物减少。香烟烟雾提取物还引起继发于二甲基精氨酸二甲基氨基水解酶活性受损的内源性NOS抑制剂的积累和二甲基二甲基氨基水解酶Ⅰ蛋白质表达的降低。使用香烟烟雾提取物后,这些改变可能与ED有关(Imamura et al,2007)。
(7)乙醇:由于其血管舒张和抑制焦虑的作用,少量乙醇可改善勃起和性行为;然而大量饮酒可导致中枢镇静,性欲降低和短暂性ED。在西澳大利亚州男性健康研究中,Chew和他的同事(2009)报道,与不饮酒者相比,目前周末酗酒者的年龄校正ED概率较低,而曾经饮酒者的年龄校正ED概率较高。
慢性酒精中毒可能导致肝功能异常、睾酮水平降低、雌激素水平升高、酒精性多发性神经病变(也可能影响阴茎神经)(Miller and Gold,1988)。在给予5%乙醇6周的兔子的体外研究中,Saito和他的同事(1994)报道了电场刺激和血管收缩药如去氧肾上腺素和氯化钾而不是硝普钠,增加平滑肌收缩和舒张,表明改变的是神经血管功能。在对亚急性乙醇效应的研究中,将小鼠暴露于乙醇蒸气7或14d,作者报道了接触14d的小鼠组中海绵状平滑肌的内皮依赖性舒张受损和内皮损伤,而暴露7d的那组无明显变化(Aydinoglu et al,2008)(表6-12)。
表6-12 药物诱导的勃起功能障碍以及替代治疗

(8)处方药和勃起功能障碍的美国社区调查:BACH调查随机抽取年龄在30-79岁的2301例男性患者进行多阶段分层研究,旨在探究ED和常用药物(包括降压药、抗精神病类药物、镇痛或抗炎类药物)之间的关系。采用IIEF-5问卷来评估ED情况。多变量分析表明苯二氮 类药物和三环类抗抑郁药物与ED相关,而抗抑郁药5-羟色胺-去甲肾上腺素重吸收抑制剂和非常规抗精神病药物则与ED无关。在排除其他干扰因素影响的情况下,使用降压药物、镇痛药物或抗炎药物进行治疗(无论是单药治疗还是与其他药物联用治疗)都与ED发生无关(Kupelian et al,2013)。
类药物和三环类抗抑郁药物与ED相关,而抗抑郁药5-羟色胺-去甲肾上腺素重吸收抑制剂和非常规抗精神病药物则与ED无关。在排除其他干扰因素影响的情况下,使用降压药物、镇痛药物或抗炎药物进行治疗(无论是单药治疗还是与其他药物联用治疗)都与ED发生无关(Kupelian et al,2013)。
9.衰老、全身性疾病及其他原因
大量研究表明健康的衰老男性性功能会逐渐下降。Masters和Johnson(1977)指出,老年男性的诸多改变包括勃起潜伏期延长、阴茎勃起程度降低、射精无力、精液量减少,以及不应期延长。一组以规律性交男性为研究对象的调查研究发现,随着年龄的增高,夜间勃起的频率和持续时间均有降低或减少(Schiavi and Schreiner-Engel,1988)。其他研究也发现,阴茎触觉敏感度也会随着年龄的增高而下降(Rowland et al,1989)。海绵体张力增加也会导致老年男性勃起功能降低(Christ et al,1990)。一项研究表明,老年ED男性睾酮水平下降,而促性腺激素水平相对正常,提示下丘脑-垂体功能障碍(Kaiser et al,1988)。血管内皮功能障碍被认为是正常人衰老的主要表现,这种衰老诱导的障碍可能是导致衰老相关的心血管疾病和代谢类疾病发病率增高的潜在“元凶”。衰老通过降低eNOS的表达以及减弱其相应作用、加速NO降解、增加PDE活性、利用内源性NOS抑制剂来抑制NOS活性、增加活性氧的产生、诱导炎症反应、减少内皮祖细胞数目及降低其功能,还可以降低端粒酶活性或引起端粒缩短等途径损伤血管内皮功能(Toda,2012)。
阴茎结构和功能改变在多种动物实验研究中均有报道。Costa和Vendeira(2008)报道称,Wistar大鼠随着年龄的增加,阴茎海绵体中的平滑肌含量会逐渐降低,而其血管口径会逐渐增大。Suadicani及其同事(2009)发现,衰老的Fischer-344大鼠的阴茎海绵体间隙连接蛋白cx43和嘌呤受体亚型P2X1R的表达会显著降低,而嘌呤受体亚型P2X7R表达增加。Ferrini及其同事(2001a,2001b)报道称,阴茎海绵体和下丘脑区域会出现诱导性NO产生增多、过氧亚硝酸盐形成,以及凋亡指数增高等表现。而衰老相关的勃起组织收缩能力增强可能是由于Rho A/Rho激酶活性升高(Jin et al,2006)、肾素-血管紧张素系统活性增强(Park et al,2005)或血管紧张素(1-7)受损介导的血管舒张导致(Yousif et al,2007)。
(1)糖尿病:糖尿病是一种常见的慢性疾病,全球范围内患病率可达0.5%~2%。糖尿病男性患者ED患病率是普通男性的3倍以上(28%∶9.6%)(Feldman et al,1994),这类患者ED常发生于早期,ED患病率随着糖尿病病程的延长而增加,30岁时ED患病率约为15%,而到60岁时ED患病率可达55%(McCulloch et al,1980,1984)。糖尿病男性患者ED患病率高于神经病变男性患者。在一项ED研究中发现,糖尿病男性患者性功能减退比率是正常男性的2倍(24%∶12%)(Corona et al,2006)。与正常男性相比,糖尿病男性ED患者隐匿型冠心病发病风险增高14倍以上,同时伴有心血管发病率和死亡率增高(Gazzaruso et al,2004)。有证据表明,可以通过糖尿病男性患者ED的发生预测将来心血管疾病的发病情况。糖尿病可能通过影响以下一种或几种因素而引起ED发生:心理健康、中枢神经系统功能、雄激素分泌、外周神经活性、血管内皮细胞功能,以及平滑肌收缩功能(Dunsmuir and Holmes,1996)。
12%的糖尿病男性患者首发症状可能是性功能减退。海绵体注射血管舒张药物后双相超声检查显示糖尿病伴ED男性患者中阴茎动脉血供不足发生率较高(>75%)(Wang et al,1993)。另外,其阴茎海绵体动脉病理改变(Michal,1980)、海绵体平滑肌超微结构改变(Mersdorf et al,1991),以及海绵体平滑肌内皮相关性舒张功能受损(Saenz de Tejada et al,1989)在糖尿病伴ED患者的阴茎样本检查中得到了证实。Hirshkowitz及其同事(1990)报道称,与相同年龄的非糖尿病男性患者相比,糖尿病伴ED的患者睡眠相关性勃起减少,阴茎勃起时间缩短,阴茎硬度降低,深呼吸时心率降低,同时伴有阴茎动脉血压降低。有研究表明,对西地那非敏感与不敏感的糖尿病患者血管内皮细胞凋亡严重程度不一致(Condorelli et al,2013)。
过去有不少研究采用1型和2型糖尿病动物模型来研究糖尿病诱发ED的基本机制。在这些动物中,糖尿病会引起内皮细胞功能障碍及导致血管疾病患病率增高的阴茎海绵体血管内皮细胞连接不全(Ryu et al,2013)。另外,糖尿病引发的其他影响还包括n NOS减少、eNOS活性降低、氧化应激、晚期糖基化终产物增加、弹性蛋白减少、VEGF含量降低、阴茎勃起组织收缩功能增强,以及阴茎海绵体中平滑肌/胶原比例下降,后者可导致静脉闭塞功能受损。Kilarkaje及其同事(2013)报道称,血管紧张素Ⅱ信号通路也与糖尿病诱发的大鼠阴茎海绵体中结构改变和氧化应激引起的DNA损伤有关。另外,卡托普利、氯沙坦和血管紧张素(1-7)可通过调节该信号通路来修复糖尿病的影响。有研究表明,活化的Rho激酶可以介导糖尿病诱发的血管精氨酸酶活化水平增高,以及阴茎海绵体舒张功能受损(Toque et al,2013)。Cellek及其同事(2013)重新修订了糖尿病性ED过程中“不可逆点”的定义,同时提出研究的重点应当集中于神经滋养血管及晚期糖基化终产物的作用,该内容引自第二次性医学国际咨询委员会会议报告(Saenz de Tejada et al,2005),见表6-13和表6-14。
表6-13 糖尿病患者的研究进展

EDHF.内皮衍生的超极化因子;NADPH.还原型烟酰胺腺嘌呤二核苷酸磷酸;NO.一氧化氮;NOS.一氧化氮合酶
表6-14 糖尿病动物模型的实验发现总结

AC.腺苷酸环化酶;AGE.晚期糖基化终产物;c AMP.环磷酸腺苷;cGMP.环磷酸鸟苷;EDHF.内皮衍生的超极化因子;ET-A.内皮素-A;GC.鸟苷酸环化酶;NO.一氧化氮;PGE1.前列腺素E1;PKC.蛋白激酶C;SOD.超氧化物歧化酶
(2)代谢综合征:代谢综合征包括葡萄糖不耐受、胰岛素抵抗、肥胖、血脂异常和高血压。据报道,与对照组相比,代谢综合征男性的ED患病率更高(26.7%),且随着代谢综合征发生紊乱的成分数量增加,ED患病率增加(Esposito et al,2005)。Rodriguez及其同事(2007)进行了一项纵向老龄化研究分析,该研究对男性进行了平均5.8年的跟踪调查,结果证实了代谢综合征的患病率。且随着年龄的增长而增加,并与较低的雄激素水平有关。他们还发现,较低的总睾酮水平,以及较低的性激素结合蛋白水平,预示着较高的代谢综合征发生率。La Vignera等(2012)研究显示,血管内皮祖细胞和血管内皮微粒的细胞转化在代谢综合征和动脉生成ED患者中水平最高,其次是有代谢综合征且无ED的男性,然后是无代谢综合征和ED的男性。在对代谢综合征和ED患者内皮功能的研究中,Tomada等(2013)报道了代谢综合征和ED患者的血管生成素失衡,并指出血管生成素可能是心血管风险较高的人群中内皮功能障碍的早期标志物。在胰岛素抵抗的Zucker大鼠中,Sánchez等(2012)报道了在阴茎动脉功能失调的氮能血管舒张中n NOS的解偶联作用(见图6-13)。
(3)慢性肾衰竭:慢性肾衰竭的男性发生性功能障碍很常见。Lew-Starowicz等于2009年对69例血液透析患者的研究发现,这些人中只有55%的人性活跃,其余都有不同的性功能障碍表现,主要表现为无性需求或性需求减少有84.7%,有44.5%发生ED,有51.5%发生射精障碍。Lai等2007年研究发现,有52%的接受腹膜透析的男性发生了ED。Peng等2007年研究发现,在血液透析患者中抑郁症的发生是非常普遍的,这也是男性血液透析患者性功能障碍的独立因素。Tavallaii等2009年研究发现,肾移植后性功能会发生显著改善。然而,Espinoza等2006年研究发现,肾移植手术后的182例男性中,有49%的男性存在ED,33%的男性有正常的性功能,18%没有性行为发生。尿毒症的许多因素可能有助于ED的发展,包括下丘脑-垂体-睾丸轴分泌紊乱、高催乳素血症、加速的动脉粥样硬化疾病和心理因素(Ayub and Fletcher,2000)。
Bagcivan等2003年的研究发现,ED可能是由于内源性NO含量降低或其生物利用度降低所致。慢性尿毒症动物模型的研究表明,功能性NO的减少可能是对包括ED在内的疾病有血管不良反应。
在慢性肾衰竭男性中,自主神经病变能促成ED的发生,一项研究发现发生神经功能障碍的血管异常和球海绵体反射异常发生率升高(Campese et al,1982;Vita et al,1999)。神经病变是终末期肾病的常见并发症,通常表现为数月内发生的远端对称性隐性发作过程。据估计,60%~100%的透析患者出现神经病变。在透析开始前,尿毒症患者的神经表现为长期去极化状态,开始透析后静息膜电位得到改善并趋于正常。去极化程度与血清K+相关,提示慢性高钾血症造成的神经细胞去极化在终末期肾病患者神经功能障碍的发生发展中起重要作用(Krishnan and Kiernan,2007)。Kaufman等1994年研究了20例接受肾替代治疗的男性患者,发现有80%的患者海绵体存在动脉功能不全和静脉闭塞功能障碍。Kielstein等2005年研究发现,尿毒症患者血清ADMA水平的升高与海绵体舒张障碍相关的NO-cGMP途径的损伤有重要的联系。
患有严重肺部疾病的患者通常会担心在性交时会加重呼吸困难;而心绞痛、心力衰竭或心肌梗死患者可能因焦虑、抑郁或动脉功能不全而性交无力。Santi 等2014年研究发现,HIV感染是ED发生的最强预测因子,许多与感染有关的因素,比如对HIV病毒恐惧、HIV感染后身体形象的变化、HIV有关的并发症、HIV感染后自身名誉的损害、安全套使用等因素都能损害勃起功能。在两项欧洲大型研究中,Corona等报道了甲状腺功能亢进增加了严重ED发生的风险,相反,研究没有观察到原发性甲状腺功能减退与ED之间的关联。其他全身性疾病,例如肝硬化、硬皮病、慢性衰弱和恶病质也可以导致ED。
10.原发性勃起功能障碍
原发性ED是指从第一次性接触开始,终身无法勃起和(或)维持勃起。尽管大多数ED是由于心理因素造成的,但少数患者存在阴茎发育不良或血液和神经供应导致的身体原因等情况。ED主要的心理功能障碍通常与由于儿时不良事件、创伤性的早期性经验或错误信息导致的性焦虑有关。尽管性欲降低可能是主要症状,但内分泌异常尤其是睾酮低下也可能与原发性ED相关。支持以上观点的研究证据仅限于几个不同数量病例的观察研究。其中最大样本的研究是Stief等于1989年进行的,此项研究观察了67例患者,其中10例(15%)主要是心理因素。患者的身体异常包括各种神经、动脉和静脉闭塞功能障碍。
(1)小阴茎:对称性的阴茎发育不良小阴茎常与尿道发育异常有关,如尿道下裂和尿道上裂(Reilly and Woodhouse,1989)或内分泌不足。在这种情况下勃起组织功能正常,其性功能障碍通常与阴茎长度及阴茎下弯畸形的程度有关,而不是与ED发生有关(Woodhouse,1998)。
(2)血管异常:外部正常的阴茎发生原发性ED是不常见的。研究发现,海绵体组织的结构异常,如缺失(Teloken et al,1993)或纤维组织被取代(Aboseif et al,1992),还有其他研究发现的血管异常,包括海绵体动脉发育不全(Montague et al,1995)或由于海绵体静脉异常引流引起的静脉闭塞功能障碍(Lue,1999)。这些先天性发育异常的根本原因是未知的,大多数情况下的治疗是血管手术或阴茎假体植入。
要点:造成勃起功能障碍的其他原因
•老龄化是ED最重要的促成因素;衰老会影响中枢调节机制,影响激素分泌、神经功能及阴茎组织结构。
•糖尿病和代谢综合征可能影响多器官系统并引起中枢和外周的结构和分子早衰造成勃起障碍。
•导致慢性肾功能衰竭的疾病也可能导致ED,并且在成功行肾移植手术后ED仍可能持续。
•原发性ED可能是心理性因素,缺乏性经验,先天性动脉供血不足或静脉通道异常所致。
要点:ED的病理生理学
•随着年龄增长和伴随疾病发生,ED的患病率增加,其发病率为25~30例每1000人·年。
•ED是许多潜在疾病的症状。
•任何影响阴茎神经、动脉、内皮、平滑肌或白膜的情况均可导致ED。
•高脂血症、糖尿病、高血压和慢性肾功能衰竭患者发生内皮功能障碍是造成ED发生的共同原因。
•与ED有关的最常见的药物包括抗雄激素药、抗抑郁药和抗高血压药。
