阴茎解剖和阴茎硬结症
PD的确切病因仍有待研究。在遗传、分子和解剖水平上正在开展的研究继续阐明这种疾病。阴茎海绵体、阴茎体,以及外周包绕的白膜,通过充血而变得僵硬。阴茎白膜是一种多层结构,主要由1型胶原蛋白组成,由内层环状和外层纵向纤维与弹性蛋白纤维交织在一起,并被一个不完整的隔膜分开(Gentile et al,1996;Brock et al,1997;Kelly,2007)。隔膜被锚定在内环层,是保持白膜结构完整性的关键,计算机模型已证明,如果没有隔膜,一侧相邻海绵体完全勃起所产生的压力足以导致白膜破裂(Mohamed et al,2010)。这些锚定部位容易受到微血管创伤和白膜层剥离的影响,可能是导致这种疾病的诱因之一(Devine et al,1997)。海绵窦支柱进一步强化了海绵体结构,在2-6点和10-6点位置锚定跨越阴茎海绵体的白膜,在5和7点位置为细柱结构(图11-2)(Brock et al,1997)。有趣的是,60%~70%的斑块位于阴茎背侧,并且通常与隔膜有关(Pryor and Ralph,2002)。在性交过程中,阴茎内的压力可能会导致两个层面的剥离,激活异常的创伤修复过程,这一过程被包裹在被膜内,从而进行性形成瘢痕。
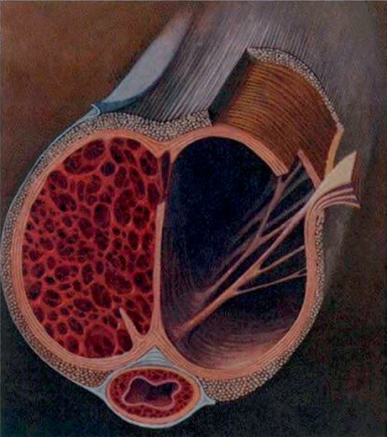
图11-2 外层纤维比较粗糙,以纵向方式排列,通常会形成一个不完整的层面(区域4-5,7-8,11-1点方向),压缩成类似于韧带的结构。图片描绘阴茎背侧和腹侧增厚和形成纵隔(Data from Brock G,Hsu GL,Nunes L,et al.The anatomy of the tunica albuginea in the normal penis and Peyronie’s disease.J Urol 1997;157:276-81.)
纵向层白膜最薄的地方在海绵体的3点和9点位置,在5和7点位置之间完全消失(Brock et al,1997)。这可能更容易造成背侧弯曲,并且解释了为什么大多数PD患者表现背侧弯曲(Devine and Horton,1988;Border and Ruoslahti,1992;Brock et al,1997;Devine et al,1997;Jarow and Lowe,1997)。在正常的白膜组织中,每一层都可明显区分,并且能够在相邻的层面上滑动。尽管白膜层很薄(1.5~3.0mm),主要取决于周围环状位置,但是白膜的正常三维结构为阴茎提供了巨大的组织弹性、硬度和强度。PD源于阴茎组织正常架构的破坏,导致所谓的“Peyronie斑块”,组织学检查表现为胶原纤维紊乱及弹性蛋白紊乱,造成海绵体不对称扩张而导致阴茎畸形(图11-3和图11-4)(Akkus et al,1997;Brock et al,1997;Devine et al,1997;Costa et al,2009)。由于存在Peyronie斑块的无弹性瘢痕,在作用于环状海绵体的一个点膨胀受限时,就会向一侧偏移,环形斑块可能导致阴茎沙漏样畸形(Akkus et al,1997;Devine et al,1997)。
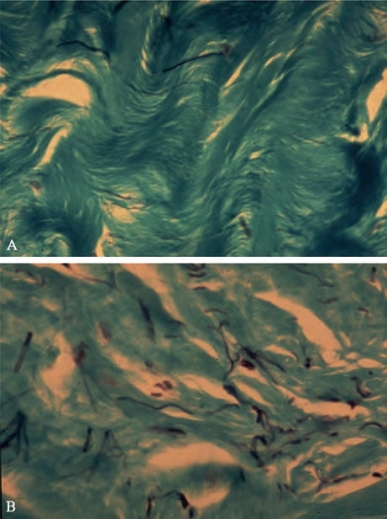
图11-3 阴茎白膜显微照片。A.正常白膜内胶原蛋白的极性排列。B.Peyronie斑块,显示胶原蛋白的非极性排列和杂乱排列的弹性蛋白。胶原蛋白染色呈绿色,弹性蛋白染色呈黑色(https://www.daowen.com)
创伤修复对PD发展的影响:一般来说,PD被认为是一种阴茎白膜创伤修复紊乱导致的疾病。近期的研究主要集中在与PD人群相关的创伤愈合、纤维化和瘢痕形成的机制上。正常的伤口愈合包括急性期、增殖期和重塑期三个阶段,这与先前描述PD的急性期和慢性期不易混淆。通过对伤口愈合过程的理解可以更好地认识PD,治疗PD的靶向药物,以及为PD研发的动物模型。一般来说,在急性期,血管损伤导致血液的溢出、血小板的聚集和激活从而释放趋化因子,触发创伤修复的级联反应,在血凝块形成的24h后激活和吸引中性粒细胞,48h后为巨噬细胞,最后在72h为淋巴细胞(DiPietro,1995)。巨噬细胞吞噬死亡或潜在的有害物质,并通过氧自由基反应破坏细菌或其他外来细胞。此外,巨噬细胞通过释放有效的组织生长因子,特别是转化生长因子,可以激活角质细胞、纤维细胞和内皮细胞,以及其他介质如TGF-α、肝素结合表皮生长因子、纤维生长因子(FGF)和胶原酶(DiPietro,1995;Ravanti and Kahari,2000)。
正常创伤愈合的下一阶段是增殖期,组织修复的转变主要开始于损伤后72h左右,大约持续2周。特点是由TGF-β和血小板源生长因子(PDGF)触发的成纤维细胞和肌成纤维细胞迁移,以及由Ⅰ型和Ⅲ型胶原蛋白、透明质酸、纤连蛋白和蛋白聚糖新合成的细胞外基质(ECM)沉积(Velnar et al,2009)。TGF-β可促进刺激成纤维细胞转变为肌成纤维细胞,厚实的肌动蛋白束可以使创伤收缩。转化生长因子-β信号也可促进成纤维细胞和肌成纤维细胞合成Ⅰ和Ⅲ型胶原蛋白(Tomasek et al,2002;Gelbard,2008)。
最后是重塑期,在正常情况下可能持续1~2年。急性创伤的重塑机制严格受到胶原以及其他ECM大分子降解与合成平衡的调控。此过程中的任何改变都可能导致异常的创伤愈合和过度的瘢痕(Velnar et al,2009)。由伤口中的嗜中性粒细胞、巨噬细胞和成纤维细胞产生的基质金属蛋白酶(胶原酶)(MMPs)是胶原降解的原因。随后被金属蛋白酶组织抑制剂(TIMPs)因子抑制。随着TIMPs的活性增加,金属蛋白酶分解基质的活性下降,从而导致新的基质沉积(Ravanti and Kahari,2000)。在PD的发病机制中也研究了TlMPs和MMPs之间的平衡,这将在本节后面部分讲述。
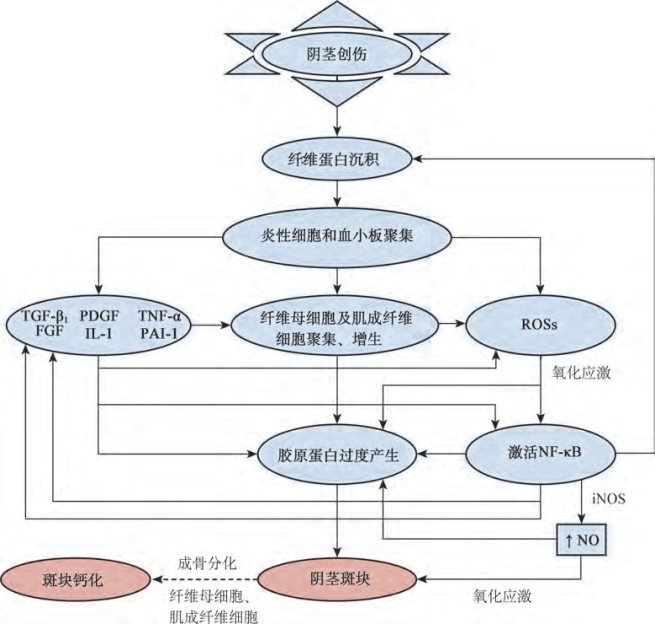
图11-4 PD的发病机制。FGF.成纤维细胞生长因子;lL-1.白介素-1;iNOS.诱导一氧化氮合酶;NF-κB.核因子-κB;NO.一氧化氮;PAl.纤溶酶原激活物抑制剂;PDGF.血小板源生长因子;ROS.活性氧化物;TGF.转化生长因子;TNF.肿瘤坏死因子(Data from Paulis G,Brancato T.lnflammatory mechanisms and oxidative stress in Peyronie’s disease:therapeutic“rationale”and related emerging treatment strategies.lnflamm Allergy Drug Targets 2012;11:48-57.)
随着时间的推移,在最后的重塑阶段,初始沉积的高度紊乱的胶原基质变得更加规整,呈交叉连接。这个过程在很多因子的调控下进行,其中最重要的是PDGF、TGF-β和FGF(Velnar et al,2009),也包括MMPs、TIMPs、纤维蛋白或纤溶酶原激活物抑制剂-1(PAI-1)(Taylor and Levine,2007;Velnar et al,2009)。重塑过程完成后,多余的成纤维细胞和肌成纤维细胞通过自噬清除。对正常创伤愈合要素的基本了解为理解PD中哪种成分出现异常提供了基础。大多数的基础研究集中在瘢痕的发展过程,这一过程导致PD患者过多瘢痕形成。近期更多研究集中在重塑过程的失调,这可能是纤维化无法解决的原因所在。
