(二)病理
男性尿道肿瘤根据肿瘤位置和尿道细胞组织学特性进行分类(Mostofi et al,1992)(图18-1)。尿道球膜部最常受累,占肿瘤的60%,其次是阴茎部尿道(30%)和前列腺部尿道(10%)。虽然传统意义上认为原发性尿道癌的主要病理类型为鳞状细胞癌,但是Rabbani进行的SEER研究显示移行细胞癌占77.6%,鳞状细胞癌占11.9%,腺癌占5%,其他组织学类型占5.5%(Rabbani,2011)。尿道癌的组织学亚型随解剖位置不同而改变。前列腺部尿道癌90%来源于移行细胞,10%来源于鳞状细胞;阴茎部尿道癌90%来源于鳞状细胞,10%来源于移行细胞;球膜部尿道癌80%来源于鳞状细胞,10%来源于移行细胞,10%来源于腺癌或未分化癌(Grigsby and Herr,2000)。
男性尿道癌可以直接向邻近组织扩散,通常累及尿道海绵体血窦和尿道周围组织,或者可以通过淋巴管转移到区域淋巴结。前尿道的淋巴回流至腹股沟深、浅淋巴结,少数回流至髂外淋巴结。后尿道癌通常回流至盆腔淋巴结。20%的病例腹股沟可触及淋巴结,与阴茎癌中大部分可触及的炎性淋巴结不同,尿道癌中可触及淋巴结通常代表了转移病灶。血行播散不常见,除非到了肿瘤的晚期。
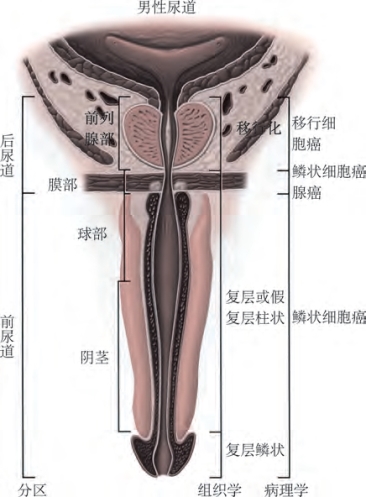
图18-1 男性尿道局部解剖及相关的组织学和组织病理学
1.评估和分期
TNM分期基于原发肿瘤浸润深度、有无局部淋巴结累及和远处转移(表18-1),包括麻醉下膀胱镜检查,外生殖器、尿道、直肠指检和会阴部的双合诊检查,有助于评估肿瘤局部侵犯的范围。也可经尿道或者针刺活检。尿液细胞学检查不是诊断原发性尿道癌的可靠方法。一项研究显示,当组织类型为移行细胞癌(80%)和肿瘤累及悬垂部尿道(73%)时,上述检查敏感度最高(Touijer and Dalbagni,2004)。如果双合诊检查或者患者症状提示直肠受累时,推荐行钡剂灌肠和纤维乙状结肠镜检查评估低位结肠,协助制订手术方案。行胸部、腹部和盆腔的CT检查能够最好地评估局部软组织侵犯、淋巴结侵犯、骨转移和远处转移的情况,在某些情况下可行MRI检查,MRI对发现阴茎海绵体的浸润尤其有帮助,是评估局部肿瘤范围最敏感的分期方法(图18-2)(Vapnek et al,1992;Stewart et al,2010)。
表18-1 尿道癌TNM分期系统

2.治疗
如同阴茎癌,男性尿道癌的主要治疗方法是手术切除。总体而言,前尿道癌更适合于手术控制,预后也比后尿道癌好,后尿道癌常发生广泛的局部浸润和远处转移(Zeidman et al,1992)。大量报道显示的总体生存率:低分期肿瘤为83%,高分期肿瘤为36%,前尿道肿瘤为69%,后尿道肿瘤为26%(Dalbagni et al,1999)。与之相近,一项纳入29例患者的研究显示(其中26例接受了初次手术切除),5年总体生存率:低分期肿瘤为67%,高分期肿瘤为33%,前尿道肿瘤为72%,后尿道肿瘤为36%,且该研究中大多数患者都接受了某种形式的辅助放疗或化疗(Thyavihally et al,2006)。
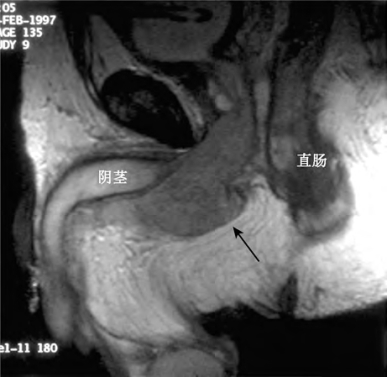
图18-2 磁共振证实的巨大球膜部尿道癌(箭头)
3.阴茎部尿道癌
对于一些浅表性、乳头状、低级别肿瘤患者,内镜切除、局部切除、远端尿道切除术及会阴尿道造口术是可接受的治疗方法,其长期无瘤生存率已有报道(Mandler and Pool,1966;Konnak,1980;Gheiler et al,1998;Hakenberg et al,2001;Karnes et al,2010)。阴茎头部尿道口周围的原位鳞状细胞癌可以侵及远端尿道(图18-3),行阴茎头部分切除术、远端尿道切除同时行尿道重建(Nash et al,1996),或阴茎尿道造口术(图18-4)即可成功治疗。2007年,Smith及同事(2007)报道了18例阴茎部尿道鳞癌患者接受保留阴茎手术的结果,其中11例为T2和T3期患者,所有患者均行手术切除,保留阴茎并重建尿道,无局部复发。因此,作者认为这是一种可行的方法,并且总体生存率不受手术方式的影响。
保留2cm阴性切缘的阴茎部分切除术适合于肿瘤侵犯尿道海绵体,肿瘤位于阴茎远端1/2的患者,已有报道其术后局部控制良好(Kaplan et al,1967;Ray et al,1977;Anderson and Mc Aninch,1984;Hopkins et al,1984;Dinney et al,1994;Gheiler et al,1998)。如果肿瘤侵犯至近端阴茎部尿道,应行阴茎全切术以保证足够的手术切除范围(图18-5),治疗后的局部肿瘤复发率为13%(Kaplan et al,1967)。需要重点强调的是,准确分期对避免低估肿瘤对近端尿道的侵犯至关重要。先前的研究数据显示,对于尿道球部肿瘤,仅行阴茎根治性切除术并不充分(Zeidman et al,1992)。

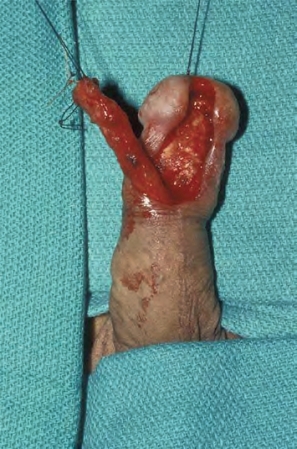
图18-3 围绕尿道开口处的阴茎头部原位鳞状细胞癌(Queyrat增生红斑),患者同时有严重的远端尿道侵犯
 (https://www.daowen.com)
(https://www.daowen.com)
图18-4 阴茎部分切除术和远端尿道切除术(与图18-3相同的患者),在保证切缘阴性后行阴茎尿道造口术
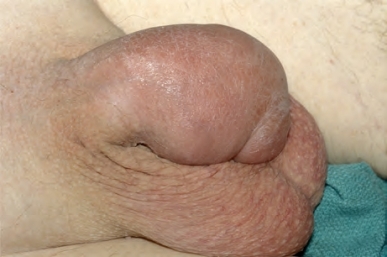
图18-5 肿大包块为阴茎部尿道移行细胞癌
虽然有一些通过放疗控制肿瘤的病例报道,但总体而言,以放疗为主的治疗仅适用于拒绝手术的前尿道早期病变患者。最常用的技术是通过导尿管将阴茎垂直提起,对应阴茎长轴区域平行照射(Heysek et al,1985)。放疗具有保留阴茎的潜在优势,但可能会导致皮肤溃疡或坏死、尿道狭窄或慢性水肿。由于很少有报道男性患者使用这种方式治疗,所以放疗的长期结果很难评估(Raghavaiah,1978;Forman and Lichter,1992;Koontz and Lee,2010)。
已有报道化疗联合放疗作为一种保留生殖器的方式用于治疗浸润性前尿道癌患者(Cohen et al,2008)。该研究纳入了9例阴茎部尿道癌患者,他们接受了预先设计的治疗方案:丝裂霉素C(MMC)加氟尿嘧啶并同期外照射放疗。5例患者完全缓解,且没有再接受针对尿道狭窄的其他治疗,1例患者因为局部复发接受了随后的补救性手术,并且至最后一次随访时仍未发现病变残留的证据。虽然研究纳入的患者例数有限,但代表了一种有效治疗肿瘤同时保留生殖器的治疗方案,有必要进行进一步研究。在下面章节内容中,所有患者队列的预后将会进一步讨论。
与阴茎癌患者不同,无明显腹股沟淋巴结增大的尿道癌患者并不能从预防性腹股沟淋巴结清扫术中获益。但已有局限性淋巴结转移被治愈的病例,所以对于有明显腹股沟淋巴结增大的患者,应考虑行腹股沟淋巴结清扫术。这同样有助于预防皮肤破溃、伤口引流及血管侵袭等局部问题的发生。
4.球膜部尿道癌
球膜部尿道的早期病变可以通过内镜切除或切除病变尿道后行端-端吻合而成功治疗。然而适合局限性切除的病例很少。无论采用任何治疗形式,目前报道的生存数据都很低,但是对某些患者来说,根治性清扫仍然是治疗中一个重要部分。根治手术通常需要行根治性膀胱前列腺切除术、盆腔淋巴结切除术和阴茎完全切除术。将手术切除范围扩大至耻骨支和邻近的尿生殖膈可能会提高切缘阴性率和肿瘤局部控制(Mackenzie and Whitmore,1968;Shuttleworth and Lloyd-Davies,1969;Bracken,1982;Klein et al,1983;Dinney et al,1994)。有单纯尿道切除并尿道会阴造口术来治疗肿瘤浸润范围局限于尿道海绵体的病例报道,但例数较少(Hakenberg et al,2001)。在某些情况下,全尿道切除、保留膀胱并封闭膀胱颈口,然后建立可控的尿流出道,可能是另一种选择(Grivas et al,2012)。在选择上述更保守术式时,应权衡其获益与局部复发或远处转移的风险。
行根治性切除术患者应取低截石位以方便经会阴入路。首先行标准的经腹膀胱切除术,术中保留盆内筋膜及前方的耻骨前列腺韧带。于会阴处行一改良的倒“Y”形或倒“U”形切口,底部为两坐骨结节内侧之间,顶部为会阴正中。在行会阴前列腺切除术时,先分离坐骨直肠窝,在直肠前方钝性分离出一个通道,并从一侧隐窝扩展至另一侧。锐性分离皮下及尿道直肠肌间隙,游离出下侧皮瓣。锐性切开皮下组织至浅表的Colles筋膜,并沿该层次分别向两侧分离至耻骨支前方的内收肌组织,游离出上侧皮瓣。于阴茎阴囊交界处环形切开皮肤及肉膜并游离海绵体,将海绵体从耻骨联合上方游离一小段距离,便于后续的耻骨下部切除术。在耻骨联合上方游离海绵体时注意不要过深,避免损伤局部进展期肿瘤的前侧。阴茎向下穿过会阴切口。如果需要可以沿阴囊中线切开,以获得更充分的显露。术中通常可保留阴囊,然而体积较大的肿瘤可能必须切除部分阴囊或会阴部皮肤,在这种情况下,睾丸可能被放置在大腿内侧皮下囊袋中。
行耻骨弓切除前,先将两侧内收肌沿闭孔内侧缘与耻骨下支锐性分离开。Gigli锯沿耻骨下支通过并向后至会阴横肌起点处。使用双侧外斜切口,便于经会阴取出标本。另外也可选择骨凿来完成。为了切除侵犯耻骨联合前组织的巨大尿道病变,可能需切除整个耻骨联合。可通过分离耻骨支和耻骨联合之间的交界处完成。然而对于大多数的病变,可以行单纯部分耻骨弓切除,保留大部分的耻骨联合。如果可能,尽可能保持骨盆的稳定性,较小引起盆底结构缺损。术中用Gigli锯穿过闭孔或用骨凿横向切开耻骨联合,进入闭孔(图18-6)。整体移出标本(图18-7)。确切止血后,游离网膜覆盖创口。完全耻骨切除术后形成的盆底缺损较大,可以用腹直肌瓣做骨盆悬吊处理。使用肌皮瓣关闭较大的会阴全层皮肤缺失(Larson and Bracken,1982)。
图18-6 阴影区域表示在行根治性球膜部尿道癌切除术中,下方耻骨切除术的坐骨耻骨支切除范围(Reprinted with permission,Cleveland Clinic Center for Medical Art&Photography©2003-2010.All Rights Reserved.)
由于后尿道进展期肿瘤单纯手术预后较差,因此多模式综合治疗越来越多。先前研究已经评估了新辅助化疗在肿瘤晚期或转移患者中的作用。包含甲氨蝶呤、长春新碱、阿霉素和顺铂的化疗方案(M-VAC)对移行细胞癌有效,但对其他组织学类型的肿瘤效果欠佳(Scher et al,1988)。Dinney和同事(1994)报道了8例患有尿道癌远处转移的病例,他们接受了铂类为基础的化疗和手术切除治疗,其中4例获得了长期生存。基于这些经验,他们推荐采用顺铂、博来霉素和甲氨蝶呤化疗方案治疗鳞状细胞癌,M-VAC化疗方案治疗移行细胞癌。
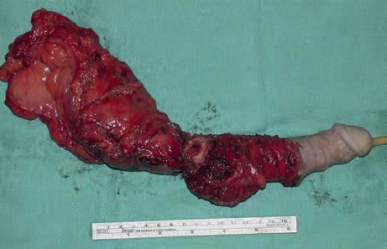
图18-7 治疗大体积球膜部鳞状细胞癌,行根治性膀胱前列腺切除术、尿道切除术、阴茎切除术和下方耻骨切除术术后的手术标本
2012年,来自Anderson医学中心研究团队进行了一项纳入44例尿道癌患者的回顾性分析,以评估铂类为基础的化疗在整个治疗中的作用(Dayyani et al,2013)。这项研究纳入了28例女性患者和16例男性患者,除1例外,其余患者均为T3或T4期,43%为N1,16%为M1。组织学亚型为混合性,主要为鳞状细胞癌、腺癌及尿路上皮癌。36例患者接受了4种以铂类为基础的化疗方案中的一种。其中5例完全缓解(14%),72%的患者完全或部分缓解,结果并没有就性别及组织学亚型进行分层统计分析。随后,其中21例接受了手术治疗,他们的平均总存活时间为25.6个月。在后期至少3年以上的随访中,上述患者中9例仍然存活,尤其是其中4例(44%)在确诊时淋巴结阳性。基于这些经验,作者认为,与高风险T2及T3a期肿瘤相似,对T3b及T4期肿瘤采用新辅助化疗是合理的。
联合化疗和放疗,在少数局部和远处转移的尿道癌患者中取得一些成功(Licht et al,1995;Oberfield et al,1996)。更多情况下,这些方法与手术一起作为局部进展和远处转移患者的综合治疗(Johnson et al,1989;Gheiler et al,1998;Grigsby and Herr,2000)。最近报道了一项纳入18例浸润性尿道癌患者的研究,患者初始即接受了包括MMC和5-氟尿嘧啶化疗并同期外部集束放疗的联合治疗,用来治疗生殖器、会阴区、腹股沟区及髂血管区淋巴结(Cohen et al,2008)。研究中,近端及远端尿道癌患者例数相近,33%为N1或N2期。15例患者获得完全缓解,3例患者接受了挽救性手术并最终因此病死亡。截至最后一次随访时,在15例完全缓解的患者中,10例未发现肿瘤存在;另外5例患者中的4例局部复发并接受了挽救性手术;4例接受挽救性手术中有2例最后随访时同样未发现肿瘤存在。因此,在接受最初的联合化疗、放疗及后续的挽救性手术后,患者5年无瘤生存率为72%。但值得注意的是,先前确认的包括肿瘤分级、T分期、淋巴结是否转移的风险因素在本试验中并未预测(Rabbani,2011)。尽管所有完全缓解且无局部复发的患者均接受了尿道狭窄的治疗或手术,但总的来说,18例中有11例避免了根治性手术。尽管这是为数不多的有稳定患者群体和治疗方案的研究之一,我们仍需要对这种方法进一步研究来确认该项单中心的研究结果。
