平滑肌生理学
与许多其他平滑肌相比,阴茎海绵体平滑肌大部分处于收缩状态。在对海绵体平滑肌细胞肌球蛋白亚型的研究中,Disant团队(1998)的研究表明,它们的组成介于主动脉平滑肌和膀胱平滑肌之间,表现为张力性和阶段性的特征,并且他们在体内及体外均检测到海绵体平滑肌的自发收缩。Yarnitsky团队(1995)在一项对男性的研究中,发现了海绵体可见自发和诱发两种电活动。Berridge(2008)提出,阴茎海绵体平滑肌的节律性收缩依赖于细胞内Ca2+泵,可以周期性地从肌浆网释放Ca2+,这种Ca2+泵可以通过神经递质和激素调节。
1.平滑肌收缩的分子机制
平滑肌收缩主要由胞质内钙离子浓度和Rho-激酶信号通路两个因素控制(Berridge,2008)。无论有无膜电位变化,平滑肌均可发生收缩(Somlyo and Somlyo,2000;Berridge,2008)。
(1)胞质游离钙:平滑肌的收缩受细胞内游离钙(Ca2+)的调节,而游离钙通过钙调蛋白发挥作用。钙结合钙调蛋白发生构象变化,增加其对肌球蛋白轻链(MLC)激酶的亲和力。MLC激酶通过与钙调蛋白复合物结合而激活,进而导致调节性MLC20的丝氨酸-19残基磷酸化。在三磷腺苷(ATP)存在的情况下,这种磷酸化使肌动蛋白激活肌球蛋白ATP酶,并启动横桥循环。ATP酶水解ATP为收缩过程提供了能量(图6-9)。当MLC20被肌球蛋白轻链磷酸酶(MLCP)去磷酸化(失活)时,肌肉收缩过程结束。MLCP是由1型磷酸酶(PP1c)、肌球蛋白靶向亚基(MYPT1)和功能未知的20k D亚基组成的全酶组成(Hersch et al,2004;Ito et al,2004)。
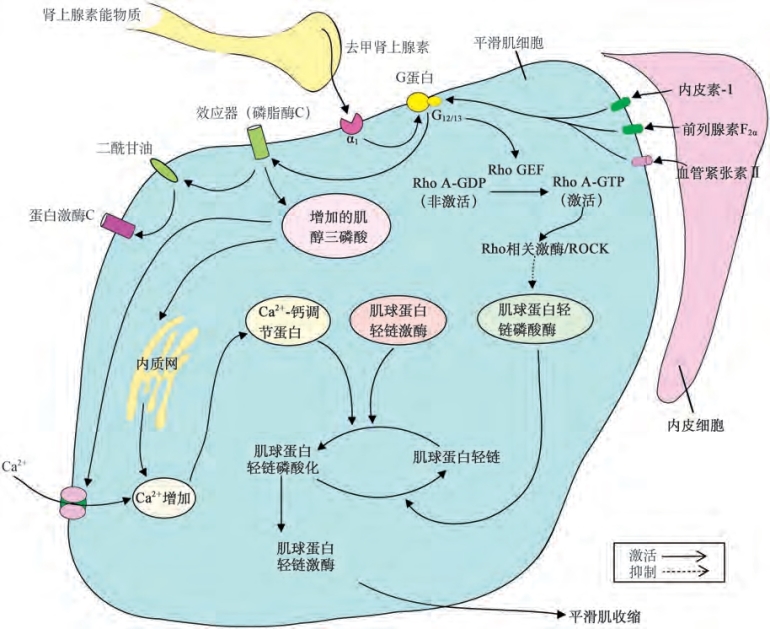
图6-9 阴茎平滑肌细胞收缩分子机制。交感神经末梢的去甲肾上腺素和内皮分泌的内皮素以及前列腺素F2α活化平滑肌细胞上的受体引发一系列反应,促使细胞内钙浓度增加,平滑肌收缩。蛋白激酶C是一种非Ca2+依赖的调节因子以维持激动剂介导的收缩反应。GDP.二磷鸟苷;GEF.鸟嘌呤核苷酸交换因子;GTP.三磷鸟苷
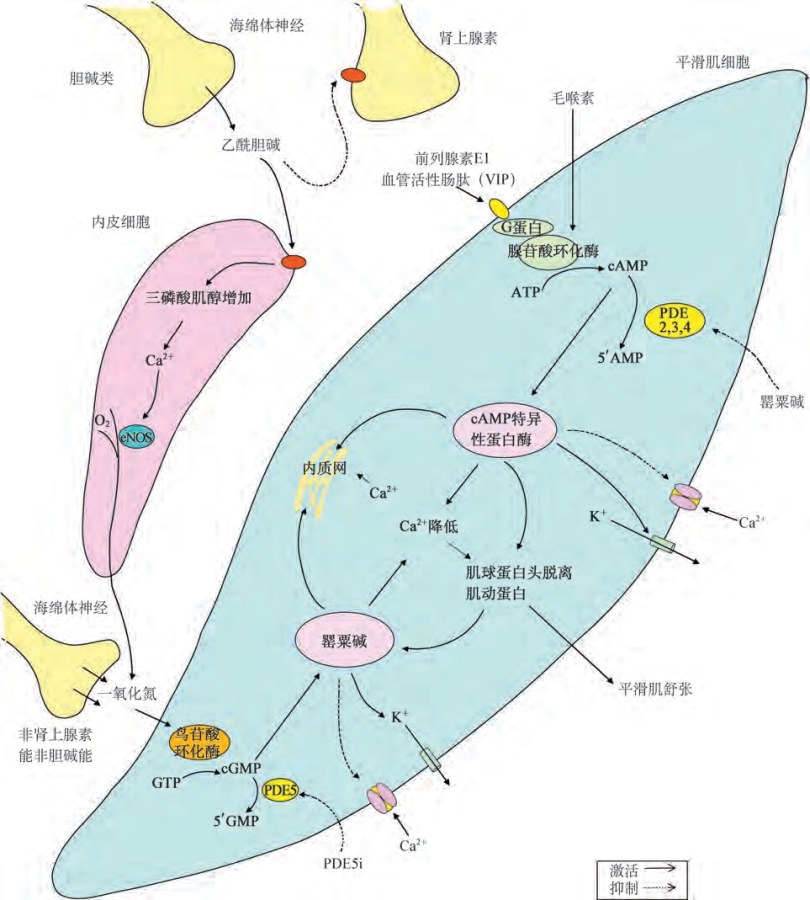
图6-10 阴茎平滑肌松弛的机制。介导平滑肌松弛的细胞内第二信使,环磷腺苷(cAMP)和环磷鸟苷(cGMP)激活它们的特异性蛋白激酶,使某些蛋白质磷酸化以引起钾通道开放,关闭钙通道并且通过内质网隔绝细胞内钙离子。使细胞内钙减少导致平滑肌松弛。西地那非抑制5型磷酸二酯酶(PDE5)的作用并增加胞内cGMP的浓度。罂粟碱是一种非特异性磷酸二酯酶抑制剂。ATP.三磷腺苷;eNOS.内皮一氧化氮合酶;GTP.三磷鸟苷
(2)Rho激酶信号通路(钙敏感通路):理论上,MLCP的抑制可能导致平滑肌收缩增强,这也被称为钙敏感通路。MLCP的活性可被Rho/Rho-激酶信号系统调控(图6-10)。Rho活化可引起Rho A与Rho-鸟嘌呤解离抑制剂的解离,从而激活Rho-激酶。Rho-激酶可使MLCP调节亚基磷酸化,进而抑制磷酸酶活性并增强收缩反应(Hirano,2007)。Rho A和Rho-激酶均在阴茎平滑肌中表达(Rees et al,2002;Wang et al,2002)。新的共识认为阴茎平滑肌的基础性收缩受细胞内Ca2+的增加所调节,而强直性收缩则受钙敏感通路的控制(Cellek et al,2002)。几项研究表明,NO对Rho A/Rho-激酶活性有调节作用(Bivalacqua et al,2007;Priviero et al,2010),Chitaley团队(2001)研究发现,Rho-激酶拮抗剂能刺激大鼠阴茎的勃起。
(3)闭锁状态——平滑肌收缩的独特特征:平滑肌具有消耗最小的能量、维持最长时间张力的能力。这种效应被称为闭锁状态,对于维持平滑肌的“基础”张力至关重要。有人认为,去磷酸化肌球蛋白在高亲和力状态下仍然与肌动蛋白结合,以帮助稳定闭锁状态。另一些人则认为,肌钙蛋白通过同时结合肌动蛋白和肌球蛋白来参与闭锁状态,以稳定横桥间的相互作用,减缓脱离的速度(Szymanski,2004)。
(4)1,4,5-三磷酸肌醇,1,2-二酰甘油和蛋白激酶C相关途径:血管收缩药如去甲肾上腺素(α1-肾上腺素能受体)、内皮素-1(内皮素-A受体)、血管紧张素Ⅱ(AT 1受体)、前列腺素F-2α(FP受体)和TXA-2(TP受体)与各自的受体结合激活Gq,进而激活磷脂酶Cβ。该膜结合酶能够水解磷脂酰肌醇4,5-二磷酸,释放出IP 3和1,2-二酰甘油。IP3与光滑内质网上的特异性c受体(IP3受体)结合,刺激细胞内Ca2+的释放。IP3与这些受体的结合不仅能够激活通道,而且还增加了IP3受体对Ca2+的敏感度,并协助钙释放。
胞内Ca2+增加的另一机制是允许细胞外Ca2+通过受体通道进入细胞(Large,2002)。去甲肾上腺素、内皮素、血管紧张素和血管紧张素Ⅱ可导致Ca2+通透性增加及非选择性阳离子通道的开放。
2.平滑肌松弛的分子机制
平滑肌收缩后,随着肌浆中游离Ca2+的减少而出现平滑肌松弛。钙调蛋白从MLC激酶解离并使其失活。肌球蛋白经MLCP去磷酸化而与肌动蛋白骨架分离,使平滑肌松弛(图6-11)(Walsh,1991)。
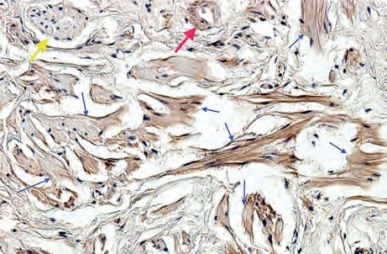
图6-11 人阴茎组织免疫组化,显示含有5型磷酸二酯酶的海绵体平滑肌纤维(蓝色小箭头)、神经(黄色箭头)、血管壁(红色箭头)(×100)
平滑肌松弛的另一个机制是通过参与平滑肌松弛的两种主要的第二信使:即环磷腺苷(c AMP)和环磷鸟苷(cGMP)来完成。它们激活c AMP依赖和cGMP依赖的蛋白激酶,磷酸化相应蛋白质和离子通道,可导致:①钾离子通道开放细胞膜超极化;②内质网隔绝细胞内钙离子;③抑制电压依赖性钙通道并阻断钙内流,从而导致胞质游离钙的减少和平滑肌松弛。
(1)环磷鸟苷信号通路:cGMP通路中的信号分子包括NO、CO、硫化氢(H 2 S)和钠尿肽。
①一氧化氮:由于分子体积小,NO可以在靶细胞内自由扩散,在细胞内与含铁血红素或铁硫复合物中含铁的分子相互作用。NO的生理相关性最强的受体是可溶性鸟苷酸环化酶(sGC),而NO-sGC-cGMP通路参与了多种内皮依赖性血管舒张药(包括组胺、雌激素、胰岛素、促肾上腺皮质激素释放激素、硝酸盐类血管扩张药和乙酰胆碱)的血管舒张作用,这一途径在阴茎生理勃起中也起着主要作用。
NO由一氧化氮合酶催化合成,其将L-精氨酸和氧分子转化为L-瓜氨酸和NO。在哺乳动物中,NOS以三种亚型存在,n NOS和eNOS分别在神经元和内皮细胞中表达;iNOS在几乎所有的细胞类型中都有表达(Hurt et al,2002;Musicki et al,2009)。这三种NOS亚型在阴茎海绵体中均有表达,其中n NOS和eNOS分别负责启动勃起和维持勃起。在大鼠和小鼠的阴茎中,还发现了一种n NOS的变异体,认为n NOS在阴茎中有两种不同的亚型(Magee et al,1996)。eNOS在阴茎勃起中起着不可或缺的作用,其活性和生物利用度受多种机制调控,如eNOS磷酸化、eNOS与调节蛋白和收缩通路的相互作用,以及与活性氧相互作用等。
②一氧化碳:CO作为第二信使,参与了由HO酶介导的血红素氧化分解代谢过程。HO酶以基本构型(HO-2,HO-3)和诱导型(HO-1)异构体的形式存在。其中,多种应激刺激可上调HO-1的分泌,HO-1在体外和体内对细胞氧化应激具有抵抗作用。CO则在调节血管,如血管张力、平滑肌增殖、血小板聚集中具有重要作用,并可能发挥着神经递质的作用。CO发挥作用依赖于直接与血红素结合的鸟苷酸环化酶的激活,同时刺激cGMP的产生。
③硫化氢:L-半胱氨酸是合成H 2 S的天然底物,外源性H 2 S或L-半胱氨酸可引起人体阴茎海绵体的松弛。腹腔内注射H 2 S、Na HS或L-半胱氨酸可诱发大鼠阴茎勃起(d’Emmanuele di Villa Bianca et al,2011)。这些研究表明,L-半胱氨酸/H 2 S可能参与调节男性和一些哺乳动物的阴茎勃起功能。
④钠尿肽:钠尿肽家族包括心房钠尿肽(ANP)、脑钠尿肽(BNP)和C型钠尿肽(CNP),它们均参与了心血管稳态的调节(Matsuo,2001)。ANP和BNP的受体是NPR-A,而CNP的受体是NPR-B。这两种受体均是鸟苷酰环化酶家族的成员,也被称为GC-A和GC-B。
研究人员已经在人体、动物海绵体和培养的海绵体平滑肌细胞中对ANP、BNP和CNP介导cGMP生成和平滑肌松弛的作用进行了研究(Kim et al,1998;Kuthe et al,2003;Sousa et al,2010)。结果表明,CNP是其中最有效的钠尿肽,它可通过与NPR-B结合而使离体海绵体平滑肌松弛。然而,CNP和NPR-B在生理勃起中是否发挥作用还有待进一步研究。
⑤鸟苷酸环化酶:在哺乳动物中,已鉴定出七种膜结合型鸟苷酰环化酶亚型(GC-A~GC-G)和一种可溶性异构体(sGC)(Andreopoulos and Papapetropoulos,2000)。虽然膜结合鸟苷酸环化酶系统在生理勃起中是否发挥作用尚未证实,但已证实GC-B可在人和大鼠海绵体中表达,并通过与CNP(GC-B配体)作用而诱导海绵体平滑肌松弛(Guidone et al,2002;Kuthe et al,2003)。
可溶性异构体sGC在勃起功能中起着关键作用,因为它介导了在生理勃起中细胞外信号分子NO和细胞内信号分子cGMP之间的联系(Andersson,2001)。sGC为一种异二聚体蛋白,由α和β亚基组成,每个亚基都存在着α1、α2和β1、β2两种亚型,分别由两个不同的基因编码(Andreopoulos and Papapetropoulos,2000)。Nimmegeers团队(2008)评估了雄性sGCα1(-/-)和野生型小鼠阴茎海绵体中sGCα1β1亚基功能的重要性,认为sGCα1β1亚基在NO和NO非依赖性sGC刺激的作用下参与了海绵体平滑肌的松弛。
⑥蛋白激酶G(PKG):又称cGMP依赖激酶,是cGMP信号的主要受体和递质。在哺乳动物中,PKG主要以两种形式存在,即PKG-Ⅰ和PKG-Ⅱ,它们由两个不同的基因编码。在平滑肌中,只有PKG-Ⅰ表达,并存在两种剪接变异体(PKG-Iα和PKG-Iβ)。cGMP和PKG-Ⅰ可能通过激活质膜Ca2+-ATP泵、抑制IP3生成、抑制Rho-激酶、刺激MLCP和热休克蛋白磷酸化等途径而引起平滑肌舒张(Carvajal et al,2000;Lincoln et al,2001)。这些机制已在很多细胞中得到证实,但同生殖系统平滑肌细胞的相关性还没有得到验证。
在PKG-Ⅰ基因敲除小鼠的海绵体平滑肌中,提高c GMP水平并不能舒张平滑肌,这些小鼠的繁殖能力很低,这可能是由于ED所致(Hedlund et al,2000a)。此研究进一步证实了cGMP/PKG-Ⅰ通路在勃起生理功能中的重要作用。
⑦环磷腺苷信号通路:c AMP信号分子包括腺苷、降钙素基因相关肽(CGRPs)、前列腺素和VIP。
⑧腺苷:当代谢率提高时,腺苷从细胞中释放出来,在高需氧状态下,腺苷对血管的作用最为明显(Tabrizchi and Bedi,2001)。然而,血管对腺苷作用的反应可能是舒张的,也可能是收缩的,这取决于激活的是哪种类型的腺苷受体。目前,已发现属于基因蛋白偶联受体(GPCR)超家族的4种腺苷受体亚型(A1、A2 A、A2B和A3)(Tabrizchi and Bedi,2001)。一般而言,A1受体被认为与Gi和Go蛋白偶联,其激活导致腺苷酸环化酶的抑制和磷脂酰激酶C的激活,这两者都会导致血管收缩。A 2受体与Gs蛋白偶联,其激活刺激腺苷酸环化酶并发挥血管舒张作用。A 3受体与Gi和Gq蛋白偶联,活化后可激活磷脂酶C/D,抑制腺苷酸环化酶,导致血管收缩(Tabrizchi and Bedi,2001)。这些腺苷受体亚型的差异分布,很大程度上决定了某一特定血管是否因腺苷刺激而舒张或收缩。腺苷在生理勃起中是否起作用尚不清楚。然而,当阴茎中腺苷过度积累,以及A2B受体信号增加时,可以刺激两种独立的突变小鼠体系阴茎的勃起:一种是腺苷脱氨酶缺陷小鼠(动物表现为延长的阴茎自发勃起);另一种是镰状细胞病转基因小鼠,这是一种公认的阴茎异常勃起的动物模型(Bivalacqua et al,2009;Dai et al,2009)。
⑨降钙素基因相关肽家族:CGRP、淀粉酶和肾上腺髓质素是CGRP家族的成员。这些短链肽是从血管周围神经纤维释放出来的强力血管扩张物质。它们通过降钙素受体样受体发挥作用,该受体属于GPCR超家族(Conner et al,2002)。
在大鼠性成熟前,阴茎、膀胱、肾、睾丸和肾上腺的CGRP水平逐渐升高,性成熟后迅速下降(Wimalawansa,1992)。在阴茎注射CGRP的ED患者中,阴茎动脉血流(勃起)出现剂量依赖性增加(Stief et al,1991)。腺病毒介导的CGRP转基因老年大鼠出现了勃起增强,这显然是通过增加阴茎海绵体中c AMP的水平来实现的(Bivalacqua et al,2001)。
⑩前列腺素类:前列腺素是一类重要的类花生酸类化合物,它们具有多种生物功能。前列腺素作用的主要方式是通过作用属于GPCR家族的特定的前列腺素受体。至少有9种已知的前列腺素受体亚型存在于小鼠和人类身上,另外还有几种带有不同羧基末端的剪接变异体(Narumiya and FitzGerald,2001)。其中4个亚型(EP1~EP4)与PGE2结合,2个亚型(DP1和DP2)结合PGD2,其余3个亚型(FP、IP和TP)与PGF2α(FP)、PGI2(IP)和TXA 2(TP)结合。根据作用的不同,将前列腺素受体分为三类。“舒张型”受体IP、DP1、EP2和Ep4与含αs的G蛋白偶联,并能刺激腺苷酸环化酶活化增加细胞内c AMP。“收缩型”受体EP1、FP和TP偶联到含有αQ的G蛋白上,激活磷脂酶C而非腺苷酸环化酶。这些收缩型受体不通过c AMP信号通路,其结果是细胞内钙的增加。EP3受体也是一种收缩型受体,但它与含有αi的G蛋白偶联,抑制腺苷酸环化酶,从而减少c AMP的形成。
动物和人的海绵体产生多种前列腺素,包括PGF2α、PGE2、PGD2、PGI2和TXA2(Moreland et al,2001)。在离体的人阴茎组织的研究中发现,不同的PG对人阴茎海绵体、尿道海绵体和海绵体动脉的作用不同(Hedlund and Andersson,1985)。PGF2α、PGI2和TXA2虽然收缩了阴茎海绵体和尿道海绵体,但PGE1和PGE2(而不是PGI2)却能够舒张因去甲肾上腺素或PGF2α引起的处于收缩状态的阴茎海绵体和尿道海绵体。虽然PGI2是主要的血管舒张药,但它在勃起组织中的作用要么是收缩性或中性的。PGI2在血管和勃起组织中的作用差异,以及PGI2和PGE1和PGE2在勃起组织中的作用差异,最有可能是由于前列腺素受体分布的差异导致的。其他研究表明,在海绵体中,前列腺素类化合物的舒张作用是由EP2和(或)EP4受体(PGE1和PGE2)介导的,而不是IP受体(PGI2)介导的(Angulo et al,2002)。
尽管前列腺素的产生和前列腺素受体在勃起组织中表达已经得到了证实,但其在生理勃起的作用仍不明确。前列素E1作为一种促勃起的药物已被广泛应用。1998年,首次描述PGE1海绵体内注射是治疗ED最安全和最有效的方法之一(Stack et al,1998),另外,经尿道应用PGE,也可用于治疗ED。(https://www.daowen.com)
○1血管活性肠肽:人或动物的阴茎富含VIP和VIP相关肽如垂体腺苷酸环化酶激活肽的神经。这些神经中大部分也含有NOS,动物和人的阴茎受神经内NOS和VIP的共同支配(Andersson,2001)。科研人员已经从人和大鼠组织中克隆了属于GPCR家族的两种VIP受体VPAC1和VPAC2亚型。培养的大鼠海绵体平滑肌细胞中已鉴定出VPAC2,而无VPAC1(Guidone et al,2002)。在狗的体内,注射VIP可诱发阴茎勃起;在男性中注射VIP(Juenemann et al,1987b),未发生坚硬勃起,但VIP与罂粟碱和酚妥拉明联合使用可提高发生坚硬勃起的成功率(Kiely et al,1989)。但是已有研究表明,VIP释放对人海绵体平滑肌神经源性舒张并不重要(Pickard et al,1993),VIP在阴茎勃起中的生理作用尚不清楚。
○12腺苷酸环化酶:c AMP通路上的信号分子结合并激活特定的细胞质膜受体,通过它们偶联的G蛋白激活腺苷酸环化酶。迄今为止,已克隆和鉴定了9种膜结合的同工酶和1种可溶性的哺乳动物腺苷酸环化酶(Patel et al,2001)。虽然不同膜结合腺苷酸环化酶的调节方式不同,但它们都可被Gα亚基的GTP结合形式激活,且所有的酶(AC9除外)都可被毛喉素激活。
在用四氧嘧啶诱导的糖尿病的家兔模型中,海绵体中毛喉素诱导形成的c AMP减少,这提示糖尿病中腺苷酸环化酶功能受损(Sullivan et al,1998)。
○13蛋白激酶A:蛋白激酶A(PKA)又称c AMP依赖性激酶,是c AMP的主要受体,它通过磷酸化胞质和细胞核内多个下游靶点来介导c AMP的大部分细胞效应(Johnson et al,2001),PKA由两个调节(R)亚基和两个催化(C)亚基组成,形成四聚酶R2 C2。c AMP与R亚基的结合使酶分解成R2(c AMP)4二聚体和两个自由催化活性C亚基。多个C亚基基因的存在进一步增加了各种全酶复合物的多样性和复杂性,其在生化和功能性质以及表达和定位模式上有所不同。同工酶的这些差异有助于PKA在多种生理过程中响应c AMP信号。
已鉴定出100多种不同的细胞蛋白为PKA的生理性底物,90%(135/145)的蛋白在丝氨酸上磷酸化,其余的在苏氨酸上磷酸化(Shabb,2001)。主要目标序列(>50%)为Arg-X-Ser,其中Ser为磷酸盐受体。在阴茎组织中发现了三种PKA底物蛋白:PDES、c AMP反应体系结合蛋白和ATP敏感钾通道。
(2)交叉激活:细胞内c AMP和cGMP水平升高可引起cAMP依赖性的和cGMP依赖性的蛋白激酶(PKA和PKG)的激活。每个环核苷酸依赖激酶都可以被c AMP或cGMP激活,但是交叉激活需要高出大约10倍浓度的环核苷酸(Walsh,1994)。虽然PKA和PKG可以磷酸化许多常见的底物,但有研究表明cGMP和c AMP激活PKG是环核苷酸降低细胞内Ca2+浓度从而引起血管平滑肌舒张的主要机制(Lincoln et al,1990;Jiang et al,1992;Komalavilas and Lincoln,1996)。
(3)磷酸二酯酶:在环核苷酸信号传导过程中,细胞内c AMP或cGMP浓度通常增加至基线的2~3倍(Francis et al,2001)。当激素信号持续存在的情况下,细胞内c AMP或cGMP浓度常常迅速发生下降。环核苷酸信号的终止主要由PDEs完成,它们分别催化c AMP和cGMP的水解生成AMP和GMP。环核苷酸水平的增加可致PDE活性上升,反馈机制有助于环核苷酸降解(Corbin et al,2000;Lin et al,2001a,2001b)。
哺乳动物PDE超家族由11个家族(PDE 1~PDE 11)组成,编码21个不同的基因(Lin et al,2003;Montorsi et al,2004)。每个PDE基因通常通过选择性剪接或替代基因启动子来编码多个异构体。PDE1、PDE3、PDE4、PDE7和PDE8是多基因家族,而PDE2、PDE5、PDE9、PDE10和PDE11是单基因家族。PDE1、PDE2、PDE3、PDE10和PDE11水解c AMP和cGMP;PDE4、PDE7和PDE8水解c AMP;PDE5、PDE6和PDE9水解cGMP。
PDE6仅在光感受器细胞中特异表达,其余的PDE均在阴茎海绵体中表达(Küthe et al,2001)。并且,有研究表明PDE5是终止海绵窦cGMP信号的主要PDE(图6-12),PDE5抑制剂抑制cGMP催化活性,可以作为治疗ED的有效方法。
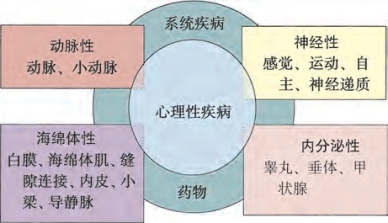
图6-12 勃起功能障碍的功能分类。勃起功能障碍由多种因素导致,大多数患者都有不同程度的心理问题;系统性疾病和药物作用可能伴随或为主要原因ED(Modified from Carrier S,Brock G,Kour NW,et al.Pathophysiology of erectile dysfunction.Urology 1993;42:468-81,with permission of Excerpta Medica,lnc.)
PDE3在勃起中也起着一定的作用,PDE3特异性抑制剂米力农的促勃起作用就证明了这一点。虽然直接抑制PDE5是西地那非发挥促勃起作用的主要机制,但已有研究表明,西地那非也能明显增加离体人海绵体组织中c AMP的浓度(Stief et al,2000)。这种效应被认为与PDE3有关,因为西地那非抑制PDE5而积累的cGMP能够通过竞争PDE3分子上相同的催化位点来阻止c AMP的降解(Francis et al,2001)。cGMP对PDE3使c AMP催化活性的减弱作用也解释了为什么PKG能够抑制毛喉素对离体的人海绵体平滑肌的舒张作用(Uckert et al,2004)。
(4)离子通道:一般来说,离子通道主要有四种类型:①外配体门控,它取决于特定的细胞外分子;②内配体门控,它取决于胞内分子;③电压门控,取决于膜电位(例如钠、钾和钙通道)的变化而开启或关闭;④机械门控,取决于机械压力。
平滑肌既没有T-小管系统,也没有发育良好的肌浆网。细胞外钙起着重要的作用,钙必须通过细胞膜进入细胞质。三种跨膜蛋白调节钙的流入和流出:钙通道是主要调节钙内流,而钠钙交换器和钙-ATP酶调节肌细胞的钙外流。在分离的海绵体平滑肌和培养的肌细胞中存在电压依赖性L型钙通道(宽脉冲电流,慢钙通道)。Christ团队(1993a)报道,在去氧肾上腺素和内皮素介导的收缩过程中,钙离子通过钙通道内流和动员细胞内储存的钙都参与了这一过程。
研究表明,海绵体平滑肌中至少有四种钾通道亚型:①钙敏感钾通道(如maxi-K);②代谢调节的钾通道(K ATP);③延迟整流;④快速瞬态A电流(Christ et al,1993a;Fan et al,1995)。钙敏感钾通道可能参与c AMP介导的平滑肌舒张。用乙酰胆碱和硝普钠处理海绵体平滑肌时,胞内钾含量降低,钾电位发生改变(Seftel et al,1996)。带正电的K+向细胞外运动引起平滑肌的超极化和舒张(Andersson,2001)。
阴茎海绵体平滑肌细胞上依赖钙激活的氯离子通道被认为参与维持自发性张力,以及参与平滑肌细胞对肾上腺素和其他激动剂的收缩反应(Fan et al,1999;Chu and Adaikan,2008)。
(5)平滑肌细胞超极化:超极化导致电压依赖性钙通道关闭,细胞内游离钙浓度降低,平滑肌舒张。超极化机制之一是钾通道的开放。ATP敏感钾通道(K ATP)和Ca2+激活的钾通道(KCa)的开放,导致血管平滑肌的超极化和舒张,这两种通道存在于人阴茎海绵体平滑肌中(Christ et al,1993b),药物刺激K ATP通道,可引起阴茎平滑肌舒张(Venkateswarlu et al,2002)。PNU-83757是一种开放的K ATP通道,它能诱导勃起。大电导钾钙通道(又称maxi-K)的开放,使人阴茎海绵体超极化和舒张(Spektor et al,2002)。PKA、PKG或cGMP可刺激K通道的开放。
阴茎平滑肌的超极化在人阴茎动脉内皮依赖性舒张中也起着重要作用,尽管NO和前列腺素的合成被阻断,但仍有明显的舒张作用(Angulo et al,2003b)。这一现象被认为是EDHF的作用,它打开了KCa通道,并产生超极化和血管舒张作用,但EDHF的性质仍未确定。
(6)氧分子作为阴茎勃起的调节剂:在疲软状态下,海绵体血的PO2水平与静脉血(≈35mm Hg)相似。在勃起过程中,由于动脉血的大量流入使PO2增加到90mm Hg左右,氧分子与L-精氨酸一起成为NOS合成NO的底物。在疲软状态下,低氧浓度抑制NO的合成;在勃起过程中,较高水平的底物诱导NO的合成。据估计,达到一氧化氮合酶激活所需的海绵体中的最低氧浓度为50~60mm Hg(Kim et al,1993)。
类似地,前列腺素H合成酶也是一种加氧酶(环加氧酶),并使用氧分子作为合成前列腺素的底物。PGE1已被证明为疲软状态时抑制其生成,勃起状态时促进其生成。内皮素合成也受氧分子调节,低氧浓度促进其生成,而高浓度抑制其生成。
(7)细胞间通信:在阴茎勃起和消退过程中,海绵体平滑肌之间应存在信息沟通,以协调同步放松和收缩(Christ et al,1991)。有几项研究表明,邻近肌细胞的膜上存在缝隙连接,这些细胞间的通道允许钙和第二信使分子等离子的交换(Christ et al,1993a)。缝隙连接的主要成分是连接蛋白-43,这是一种在人阴茎海绵体平滑肌细胞之间发现的不足0.25mm的膜保护蛋白(Campos deCalvalho et al,1993)。通过这些缝隙连接介导的细胞间通信很可能解释了同步勃起反应的出现,但是它们的病理生理作用尚不清楚。
3.海绵组织结构
海绵体的小梁为内皮排列的窦腔提供了结构支持和调节靶点,也为血管和神经在海绵体内穿行提供通道,小梁的舒张使窦腔扩张,而其收缩将血液排出到导静脉,使阴茎恢复到疲软状态。在24例重度ED阴茎假体植入患者中,Nehra和他的同事(1996)将阴茎海绵体平滑肌含量分为高(39%~42%)、中(30%~37%)、低(13%~29%)和正常(42%~50%)4组,结果显示,静脉漏程度与肌肉含量有关。Costa等(2006)研究了6例因非生殖系统疾病死亡的男性海绵体标本,结果表明,海绵体小梁的主要成分是胶原纤维(40.8%)、平滑肌(40.4%)和弹性纤维(13.2%)。而7例接受了阴茎假体植入的7例男性的海绵体中,海绵体小梁由胶原纤维(41.6%)、平滑肌(42%)和弹性纤维(9.1%)组成。与正常男性相比,ED患者的小梁成分的唯一显著变化是弹性纤维的减少。这两篇报道表明,与ED有关的海绵体组织学改变可能主要是平滑肌或弹性纤维含量的下降。
阴茎的复杂结构是由多种营养因子的动态表达和相互作用维持的。其中一种是sonic hedgehog(SHH),其在调节脊椎动物器官发生中起关键作用,例如肢体和脑组织的生长。SHH因子在人体中仍然很重要,它可以控制成体干细胞的细胞分裂,并参与到一些癌症的发展过程中。阴茎中已经发现了SHH因子的存在;成年大鼠SHH因子被抑制,导致其海绵体的快速萎缩和解体(Podlasek et al,2003,2005)。此外,研究发现,SHH因子也可以刺激阴茎血管内皮生长因子(VEGF)和NOS的表达(Podlasek et al,2005)(表6-9)。
要点:海绵体平滑肌生理学
•海绵体平滑肌的松弛是阴茎勃起的关键。
•海绵体神经末梢中n NOS释放NO引发勃起过程,而内皮中eNOS释放NO保持勃起状态。
•NO进入平滑肌细胞时,会刺激平滑肌细胞产生cGMP。
•cGMP因子能激活PKG,打开钾离子通道并关闭钙离子通道。
•平滑肌细胞胞质低钙水平有利于平滑肌松弛。
•当cGMP被PDE降解时,平滑肌张力恢复。
表6-9 参与海绵体平滑肌的生理调节的关键分子
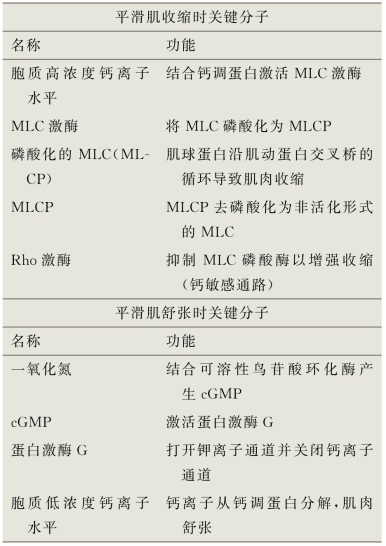
cGMP.环鸟苷单磷酸酯;MLC.肌球蛋白轻链;MLCP.肌球蛋白轻链磷酸酶
