(四)治疗
虽然尿道狭窄的治疗取决于泌尿外科医师的专业水平,但是50年来的显著进步,使得许多复杂的狭窄能够实现一期重建。在过去,重建阶梯的概念是尿道狭窄治疗的指南。这个概念基于一个原则:最简单的操作应当最先尝试,甚至反复尝试,然后再考虑尝试稍复杂的操作。现代尿路重建理念认为其方法过于原始。
选定治疗方案之前,患者及医师都要准确地理解治疗的目标。应当与患者探讨治疗选择,强调预期结果并告知可能治愈。一些患者宁愿选择在办公室、家中或医院进行尿道扩张而不愿接受手术治疗。另一些患者以治愈为目标而选择手术治疗。如今多种术式的近期、中期,甚至远期成功率可达到90%~95%。
1.尿道扩张
尿道扩张是治疗尿道狭窄的最古老和最简单的方法,对那些没有海绵体纤维化的上皮性狭窄患者来说,这种治疗手段可获得治愈的效果。这种治疗方式的目的是在不产生更多瘢痕的前提下拉伸瘢痕,这一点往往被忽略。如果在扩张时伴有出血,那么狭窄部位更多的是被撕裂而非伸展,这也进一步损伤了该区域。扩张尿道创伤最小的方法是使用轻柔的操作技术。我们认为,目前最安全的尿道扩张方法是使用尿道球囊扩张导管。这些导管可附着在丝状端或通过导丝引导通过狭窄段。对于初次扩张,推荐在内镜引导下通过导丝引导将球囊置入尿道(Steenkamp et al,1997)。
2.尿道内切开术
尿道内切开术是指经尿道将狭窄段切开的手术方式。尿道切开术包括切开瘢痕组织至正常尿道组织以使瘢痕部位扩张(松解挛缩瘢痕)并使其管腔扩张愈合。其目的是使管腔内径能够增大并在愈合后维持。
上皮对合后,切口即开始一期愈合。尿道内切开术的目的不是为了使上皮对合,而是为了分离瘢痕化的上皮,使其发生二期愈合。在二期愈合的过程中,上皮化从切口边缘开始形成。由于从切口边缘开始,上皮化进展缓慢。为了加速上皮化,需要刺激切口收缩,而非瘢痕挛缩。切口收缩使缺损区域闭合并限制了需上皮化区域的大小,加速了切口表面缺损的愈合。但在尿道内切开术中,切口收缩的目的仅仅是尽量让瘢痕边缘接近以加速上皮化。如果上皮化完成先于切口收缩导致的尿道管腔明显缩窄,那么尿道内切开术是成功的。反之,狭窄将再次形成。Dubey和同事(2005)表示,管腔内狭窄的程度可预测尿道内切开术能否成功:狭窄段尿道狭窄程度越重,预后越差;74%的狭窄率可作为临界点。
许多外科医师已掌握尿道内切开术,即在12点处单点切开。但基于尿道在海绵体内的走行,这一切开位点也受到质疑。在对尿道海绵体横切面的分析中可以看到海绵体前段最薄的部分位于10-2点区域。而尿道壁和阴茎海绵体之间的距离同样较短,单纯的12点切开可迅速穿透尿道海绵体并延伸至三角韧带,虽然不一定会进入阴茎海绵体,但深部切开可能会进入阴茎脚间隙。虽然远端尿道海绵体的前部较厚,但在更远端前尿道内行深部切开也可能损伤阴茎海绵体,而这些切开可导致阴茎勃起功能障碍,原因主要是局部的阴茎海绵体静脉闭合功能异常。在球部尿道10-2点的切开也面临同样的问题。如果狭窄部位存在深部海绵体纤维化,则尿道内切开术无法治愈,因此不必行深部切开。
尿道内切开术最常见的并发症是再狭窄。其他并发症主要包括出血(几乎均由术后勃起导致)、灌洗液外渗至海绵体周围组织。但这些并发症如今都已少见,主要是因为内切开术现已较少用于尿道狭窄的治疗。在行内镜下尿道内切开术时需要用生理盐水作为灌注液。此外,随着深部尿道内切开术的开展,出现了新的并发症,即阴茎海绵体-尿道海绵体瘘和海绵体静脉闭塞功能障碍。
在评估尿道内切开术成功率方面存在的主要问题是,对已经进行尿道内切开术的狭窄段的性质的报道很少。另外,文献中没有明确指出尿道内切开术的目的。多数情况下,若能暂时缓解症状就认为内切开术是成功的。因此,在许多病例中尽管最终再次出现了尿道狭窄,尿道内切开术仍被视作成功。一项由Santucci和Mc Aninch(2001)运用精算方法所计算的报道显示,尿道内切开的愈合率接近20%(Rosen et al,1994)。Pansadoro和Emiliozzi等(1996)报道,内镜下尿道内切开术的治愈率为30%~35%。另外,他们在分析中也提到,再次尿道内切开术并不能实质性地增加手术成功率。数据显示,球部尿道<1.5cm且没有致密的深部海绵体纤维化(如骑跨伤)的狭窄段可通过尿道内切开治疗,其长期成功率可达74%。Pansadoro和Emiliozzi(1996)的研究并没有涉及球部尿道以外的狭窄段的长期成功率。尿道内切开的成功率已被其他研究证实(Heyns et al,1998)(Boccon-Gibod,personal communication,2005)。许多研究表明,此前的多次尿道扩张和尿道切开术会降低重建的成功率。尿道内切开术的成功率与开放尿道重建的成功率并不等同(Mandhani et al,2005)。人们进行了大量的分析,试图评估在决定行开放重建手术之前进行尿道内切开能否给患者带来获益。这些分析,其方法各异,结论也不同(Rourke and Jordan,2005;Wright et al,2006;Wessells,2009)。
多种技术被用来阻止伤口收缩的进程,以防止再狭窄的发生。一种方法是在尿道内切开术后留置Foley导管6周,以期尿道能围绕导管完成切口愈合。但研究显示,尿道内切开术后长期留置导尿管的失败率与留置导尿管3~7天的失败率是相似的,甚至于6周还不足以抵抗切口的收缩力。
另一种用来抵抗尿道内切开术后伤口收缩力的方法是家庭自我导尿或称家庭尿道填塞。尿道内切开术后患者一般会留置导尿管3~5天,当导尿管拔除后,患者即开始尿道填塞疗法。大多数疗法在恢复早期需要频繁放置导尿管,在接下来的3~6个月慢慢减少。有趣的是许多文献已经报道内切开术联合自我导尿可提高治愈率。但据我们的经验,不论患者坚持自我尿道填塞多长时间,一旦停止,狭窄不可避免地会再次发生。现在普遍认为,若患者自行规律尿道扩张的依从性较好,则该方法能够较好地控制病情。由于秋水仙碱可与微管蛋白结合,因而被用于尿道内切开术中(Carney et al,2007)。一项非随机对照研究的初步发现也提示,可能由于秋水仙碱能够阻断微管蛋白,进而抑制切口收缩,从而提升了尿道内切开术的疗效。丝裂霉素C具有抗纤维化和抗胶原活性,注入黏膜下可降低内切开术后狭窄复发(Mazdak et al,2007)。
尿道支架(永久性或临时性放置)也是一种内切开术或扩张术后用来对抗伤口收缩力的手段。临时尿道支架抑制上皮化,防止与尿道壁发生融合,一般可放置6~12个月。运用临时支架最好的经验来自于以色列(Yachia and Beyar,1991),那里的中心报道了在小范围的使用中获得了良好的效果。Memokath支架是镍钛合金材质的临时支架,其报道成功率各有不同,目前尚不能在美国使用。
绝大多数使用永久性支架的经验来自英国和欧洲其他各国。Milroy(1993)报道了使用永久性植入性Uro Lume后4.5年84%的成功率(Rousseau et al,1987;Sigwart et al,1987;Milroy et al,1988,1989;Sarramon et al,1990;Ashken et al,1991;Krah et al,1992;Sneller and Bosch,1992;Verhamme et al,1993;Badlani et al,1995;Milroy and Allen,1996;Jordan,1997;Tillem et al,1997;Brandes and Mc Aninch,1998;Shah et al,2003)。Uro Lume使用合金制造,可植入尿道壁和尿道海绵体内,并被组织包裹。已有的数据显示,支架最好植入相对较短且海绵体纤维化程度相对较轻的球部尿道狭窄段内。然而对于这些狭窄段,开放手术也能够予以成功重建,且具有更高的远期成功率。北美研究组(the North American Study Group)11年的研究数据显示,179例患者中的24例完成了11年的随访,这些患者的总体成功率不足30%(Shah et al,2003)。一项荷兰的10年随访数据显示,其远期结果不如预期的乐观,15例植入支架的患者中只有2例在10年后仍有满意效果(De Vocht et al,2003)。
永久植入性支架也有并发症。这些支架只能用于球部尿道,若放置超出了阴囊段尿道,可出现坐位及性交时疼痛。有些患者(特别是年轻患者)主诉会阴部疼痛,常发作于剧烈运动后,即使是在球部尿道深部放置支架也有可能发生。此外,长段球部尿道狭窄需要重叠放置两个支架,两个支架可发生移动,使得他们之间出现间隙,从而导致尿道狭窄再次发生。当狭窄再次发生时,需切除狭窄段并放置第三个支架。
使用Uro Lume也存在特殊的禁忌证。曾行替代尿道重建手术的患者,尤其是以皮肤作为移植物进行重建的患者不宜放置Uro Lume支架,因为皮肤与支架接触后会产生强烈的增生反应,导致患者出现排尿后滴沥,甚至出现功能性尿道狭窄复发。深部海绵体纤维化导致尿道狭窄的患者也不宜使用Uro Lume支架,包括因尿道离断损伤及骑跨伤而导致深部纤维化的患者。目前,Uro Lume已退出市场,不能再被使用。然而,仍有很多患者已植入Uro Lume支架,也有许多患者需要类似产品的治疗。
3.激光
该部分内容见Expert Consult网站。
到目前为止,关于尿道内激光切开术的结果尚无一致的结论。然而,随着新型激光的出现及经验的积累,未来可能会有更好的治疗效果。
4.开放性重建手术:瘢痕切除并尿道吻合术
目前认为,最可靠的前尿道重建手术是将狭窄区域的纤维组织切除,使尿道断端显露正常组织,再将断端进行一期吻合(图20-19)(Russell,1914)。满足下列操作要点时,即可获得最佳的手术效果:纤维化组织被完全切除,尿道吻合口宽敞呈卵圆形,吻合口无张力。
该手术的成功主要依靠尿道海绵体良好的活动性。以良好的活动性为基础,剥离Buck筋膜来提高顺应性,扩大阴茎脚之间隙,从会阴体将球海绵体肌分离,可将狭窄段全长切除并再吻合。1~2cm的狭窄段通常较易实施该手术。在某些情况下,3~5cm的尿道狭窄也可完全切除并行一期吻合。对于极近端球部尿道的较短狭窄,可通过分离膜部尿道来协助完成无张力吻合(图20-20)。有一条规律是:越靠近膜部尿道的狭窄,即使狭窄段较长,仍可通过吻合技术进行重建。对于近端狭窄来说应优先选择单层吻合。当狭窄过长以至于影响切除纤维化组织并吻合时,则需要移植物进行替代。Morey和Kizer(2006)报道了一组狭窄段为5cm且接受了瘢痕切除并尿道吻合术的患者。他指出,年轻患者的组织有更好的顺应性,因此可将手术指征放宽。
DeCastro等(2002)报道了前尿道狭窄行瘢痕切除并尿道吻合术后出现的有趣的情况。在一个病例中,患者存在两个独立的狭窄段,期间为完全正常的尿道和海绵体。术者分别切除狭窄段并各自吻合。尽管手术获得了成功,但我们认为是术者丰富的手术经验才使手术有了满意的效果,而使用镶嵌(onlay)或扩大镶嵌(onlay)来进行更为安全的尿道重建可能是更好的选择。
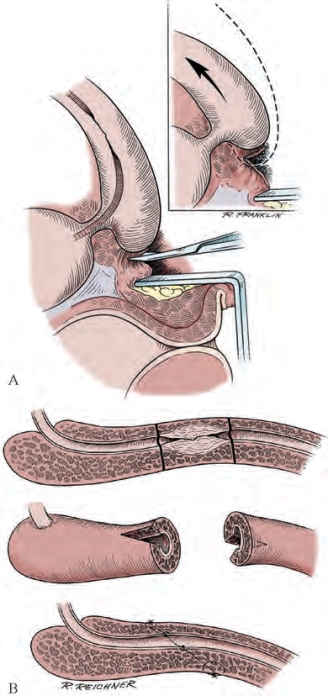
图20-19 前尿道狭窄切除一期吻合术示意图。A.从会阴体将球海绵体肌游离,保持球部动脉完整;该操作可帮助尿道向远端游离,联合扩大阴茎脚间隙的操作,可使尿道走行的距离缩短1.0~1.5cm。B.前尿道狭窄切除后的楔形吻合技术(From Jordan GH.Principles of plastic surgery.ln:Droller MJ,editor.Surgical management of urologic disease:an anatomic approach.Philadelphia:Mosby;1992.p.1218-37.)
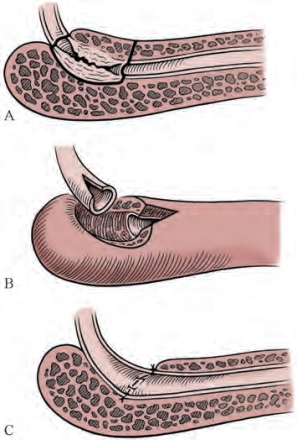
图20-20 极近端球部尿道狭窄切除吻合术。剖开膜部尿道可使操作更为简便。A.确定需要进行切除的狭窄部位。B.狭窄部位已切除,两断端均于背侧做切口。C.吻合完成
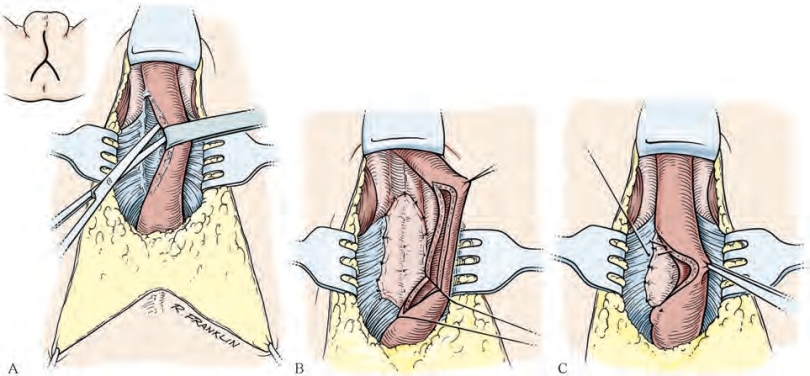
Jordan等(2007)首次报道了球部尿道保留血管的瘢痕切除并尿道吻合术。组织分离方式与传统方式(图20-21)类似:离断三角韧带,扩大阴茎脚之间隙,分离膜部尿道与近端血管网,这些血管均可得到保留(图20-22)。离断尿道切除狭窄段组织,修剪尿道断端后予以吻合。Andrich和Mundy(2012)描述了一种可用于近端狭窄的血管保留技术:沿海绵体背侧纵向剖开,从尿道内侧切除瘢痕组织,从而避免影响尿道海绵体表面走行的血管。狭窄段切除后,首先对合腹侧尿道;海绵体背侧纵向切口予以横向缝合,血管得以保留。保留球部尿道近端血供,对于末梢循环因外伤、既往手术或尿道下裂而损伤的患者来说是有益的。另有一个理论上的好处是:可能会减少勃起功能障碍的风险,若后期植入人工括约肌还可能会降低腐蚀的风险。还需要更多的研究以证实血管保留技术的良好效果及其理论上的优势(Jordan,et al,2007;Gur and Jordan,2008;Andrich and Mundy,2012)。
成功用于一期尿道重建的4种游离移植物是:全厚皮片、膀胱上皮、口腔黏膜和直肠黏膜。前已述及,口腔黏膜可取自颊(颊黏膜)、唇(唇黏膜)或舌(舌黏膜)。刃厚皮片已被用于前尿道分期重建(Humby,1941;Memmelaar,1947;Pressman and Greenfield,1953;Devine et al,1976;Hendren and Crooks,1980;Schreiter and Koncz,1983;Webster et al,1984;Hendren and Reda,1986;Ransley et al,1987;Burger et al,1992;Jordan,1993;El-Kassaby et al,1996;Wessels and Mc Aninch,1996)。各种游离移植物的特征及微血管分布已在修复重建外科原则部分探讨。
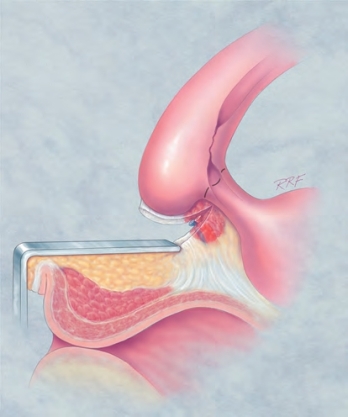
图20-21 离断近端尿道海绵体、球海绵体肌及膜部尿道示意图。常规操作中,从膜部尿道与近端球部尿道交界处切开,以切除狭窄部位并行一期吻合。本图所示,近端血管予以结扎并离断。可在膜部尿道的最远端位置予以离断
曾经皮瓣重建技术盛行的时代,游离移植物重建几乎全被抛弃。但在20世纪90年代后期,人们开始重新关注游离移植物(Wessells and Mc Aninch,1996),尤其是口腔黏膜移植物(Hellstrom et al,1996;Weinberg et al,2002;Barbagli et al,2003;Elliott et al,2003;Bhargava and Chapple,2004;Kellner et al,2004;Xu et al,2004;Dubey et al,2005)。包埋在坐骨海绵体肌中的球部尿道是移植物使用最成功的部位,但尿道其他部分使用游离移植物的报道也越来越多。游离移植物可用于尿道腹侧,然而除非考虑使用海绵体肌成形术,腹侧尿道切开仍具有其优势(图20-23)。海绵体成形术要求邻近狭窄段的尿道海绵体相对正常且无纤维化。有数据支持背侧镶嵌(onlay)的优越性,也有文献指出两者在成功率上并没有差别。过去我们倾向于选择侧方移植物镶嵌(onlay)(见图20-23B)或背侧移植物镶嵌(onlay)(见图20-23C)。侧面行尿道切开可使术者在切开尿道海绵体的同时显露尿道,这也是尿道相对薄弱的地方,有利于防止出血并尽量显露手术视野。另外,在球部尿道移植物需缝合至底层肌肉床以期使之更好地固定与贴合。
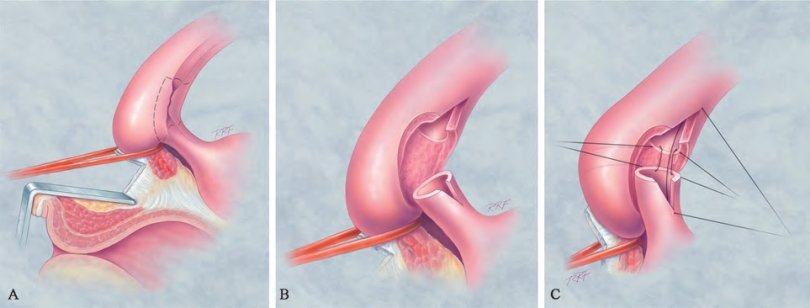
图20-22 保留血管的狭窄切除一期吻合术。近端尿道海绵体、球海绵体肌和近端血管周围及膜部尿道均被离断。A.在近端血管和膜部尿道之间离断,这样可以保留供应球部的动脉,并在膜部和球部交界处将尿道离断;在此区域可将近端狭窄予以切除。B.放置吻合缝线之前,将狭窄部分切除。C.放置缝线,完成楔形吻合。我们常规交替使用聚二氧六环酮缝线和可吸收单股缝线,但所有的可吸收缝线均可使用
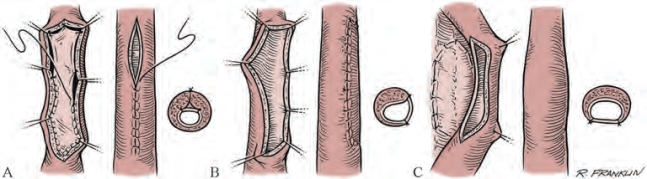
图20-23 多种移植物镶嵌(onlay)技术。A.腹侧镶嵌海绵体成形术。B.固定于坐骨海绵体肌进行侧方镶嵌。C.展平并固定后进行背侧镶嵌
Monseur尿道重建术只运用于几个特定中心(Monseur,1980)。此术式要求在狭窄段背侧切开。狭窄段的边缘保持分离状态,并缝合至三角韧带底层或(和)阴茎海绵体。Barbagli等(1995)改良了该术式(图20-24)。在改良后的术式中,狭窄段背侧被切开,切开处放置移植物,展开并固定于三角韧带或(和)阴茎海绵体上。之后,狭窄段切口的边缘与移植物边缘缝合且缝合至邻近组织。此术式效果卓越。腹侧和背侧移植物镶嵌(onlay)技术可用于狭窄段切除和条状吻合术(扩大吻合术)(图20-25)。对于近端狭窄,扩大吻合术中血管保留技术的使用取决于术者是否有能力在不完全游离尿道海绵体的前提下切除瘢痕化的上皮及下方海绵体组织。
另外一种方法是使用网状刃厚皮片、口腔黏膜或耳后全厚皮片进行分期手术。在第一期手术过程中,将刃厚皮片、口腔黏膜或Woff移植物植入肉膜组织内。如果此期将移植物植入白膜或阴茎海绵体内,会限制移植物的活动度,而使第二期的卷管手术难度增大。但是在移植物和阴茎海绵体之间存在的中线有其优点。之后可进行二期手术将移植物卷管。虽然率先提出使用网状刃厚皮片进行移植的Schreiter和Noll(1989)会在3~4个月进行二期手术。但是若使用了刃厚皮片,我们会在一期手术后等待12个月再进行二期手术。美国和欧洲的病例证实了该术式的效果。在美国,多数疑难病例会选择此术式,大部分病例仍会选择一期重建。如前所述,分期移植技术已被充分运用于复杂性尿道下裂患者。颊黏膜分期手术应用于LS患者,且中期随访显示手术成功。此外,在复杂性尿道下裂患者中已成功使用了颊黏膜和耳后皮片行分期移植(图20-26)。
 (https://www.daowen.com)
(https://www.daowen.com)
图20-24 Barbagli提出的背侧移植物镶嵌技术。A.将尿道海绵体从三角韧带及阴茎海绵体分离。B.行背侧尿道成形术,移植物展平并固定于阴茎海绵体上,注意与切口位置对应。C.将狭窄切开处的边缘同移植物和阴茎海绵体缝合
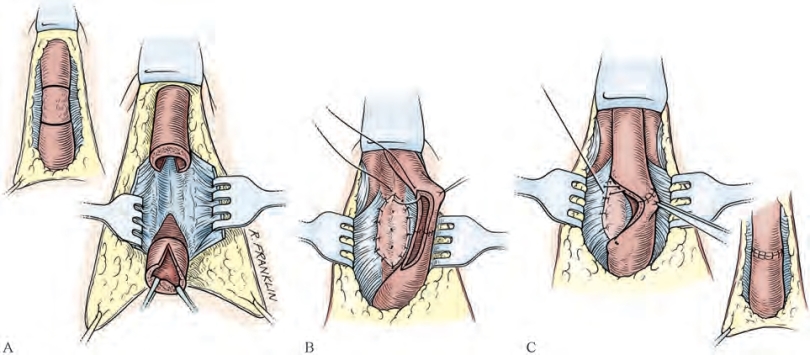
图20-25 移植物镶嵌扩大吻合术。A.将尿道海绵体从三角韧带及阴茎海绵体分离,辨别并标记海绵体纤维化区域,将管腔最狭窄处切除,尿道两断端做背侧切口。B.双层条带状吻合,移植物展平并固定于阴茎海绵体上,注意与切口位置对应并使用褥式缝合。C.将狭窄切开处的边缘同移植物和阴茎海绵体缝合
有许多人提出使用来自阴茎或阴囊肉膜的生殖器岛状皮瓣修复尿道狭窄。曾经,这些“皮瓣手术”被认为是独立的手术方式。我们认为这些术式均是同一理念的不同应用,就像Quartey(1983)的微注射研究所提出的那样。皮瓣可看作源自于筋膜瓣,因此尿道重建的皮瓣设计与其他部位重建的皮瓣设计是类似的。
在尿道重建过程中使用皮瓣需考虑以下三点:皮瓣组织的特性、皮瓣组织的脉管系统及皮瓣组织转移的力学改变。用于尿道重建的皮肤必须是无毛的。另外,从供区角度考虑,最方便的就是使用富余的生殖器无毛发皮肤。
若富余的皮肤堆积在生殖器背侧,按照1984年Duckett和Standoli描述的技术,岛状皮瓣可以横向取材转移到背侧的肉膜组织上(图20-27)(Duckett,1986;El-Kassaby et al,1986;Duckett,1992;Duckett et al,1993)。如果腹侧有皮肤堆积,可做腹侧纵行岛状皮瓣进行转移。这些岛状皮瓣既可以大范围将腹侧肉膜皮瓣转移至会阴,也可以小范围游离翻转修补悬垂部尿道狭窄(图20-28)(Orandi,1972)。腹侧岛状皮瓣可以横向(图20-29)或纵向取材。较长的岛状皮瓣可以在其远端腹侧横向取材。“L”形皮瓣长度可达7~9cm(图20-30)。对于前尿道远端(包括尿道外口、舟状窝及悬垂部尿道)狭窄来说,这些岛状皮瓣可通过构建阴茎头侧翼或修复阴茎头腹侧以重建尿道外口。
通常阴茎皮肤有堆积较多,可环形切取岛状皮瓣。这些环形岛状皮瓣游离自整个阴茎肉膜,皮瓣转移机制表明当皮瓣基于腹侧且蒂位于背侧时,效果更佳。某些情况下,环形岛状皮瓣可达15cm(El-Kassaby et al,1986;Mc Aninch,1993;Miller and Mc Aninch,1993)。所谓的“Q”形环状设计可提供长度更长的岛状皮瓣,这对复杂长段前尿道重建非常必要(Morey et al,2000)。
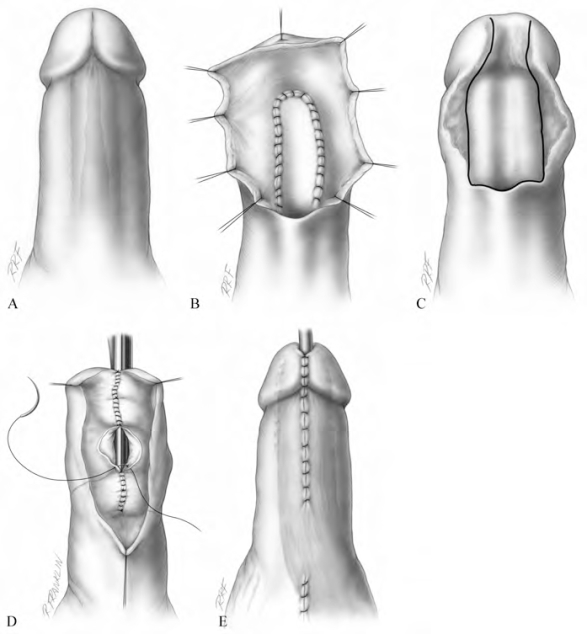
图20-26 前尿道远端狭窄分期修复重建。A.狭窄段尿道示意图(阴影区域为累及悬垂部尿道远端的舟状窝狭窄)。B.切除舟状窝狭窄,并向近端尿道切开直至正常组织;使用颊黏膜移植物修补缺损,切开段腹侧不予关闭。C.6个月后移植物成熟,图中标示区域将闭合为Tiersch管。D.紧密缝合Tiersch管,远端尿道腔径保持约28Fr。E.阴茎头重建,皮肤缝合(阴影区域示来自于侧方的肉膜瓣);肉膜瓣来自左半睾丸包膜,移位覆盖整个尿道重建区域
很多时候,行狭窄切除联合皮瓣镶嵌(onlay)(图20-31)或游离移植物镶嵌(onlay)扩大吻合术(见图20-25)可获得较好的疗效。我们发现要处理程度较重(几乎或完全闭塞)的尿道狭窄段往往较为困难。这些狭窄段常能够被完整切除;吻合一侧尿道壁,剩余的缺损处可用移植物或皮瓣覆盖。有些患者的阴囊皮肤上有较大的无毛发区域,可从阴囊肉膜表面游离。曾有文献报道,使用该区域皮瓣效果不佳,但据我们和其他中心的经验和典型病例来看,患者预后良好。筋膜瓣须以侧方为基底才可靠。由于肉膜含有丰富的肌肉成分,因此岛状皮瓣须仔细裁剪。若开始时就能正确裁剪皮瓣,它们就不会像曾经所认为的那样容易发展为憩室。虽然阴囊岛状皮瓣不是我们的首选,但若遇到疑难病例,这可作为一个不错的选择。
这些将岛状皮瓣定向于阴茎肉膜筋膜的方法对于舟状窝的重建也是有用的(Cohney,1963;Blandy and Tresidder,1967;Brannen,1976;De Sy,1984;Jordan,1987;Armenakas et al,1998)。过去,尿道狭窄或舟状窝狭窄往往通过反复尿道扩张或连续尿道外口切开术进行治疗。由于尿道外口切开术长期看来成功率极低,这项技术发展到后来要求将任意的阴茎皮瓣填塞到尿道切开的缺口处。这些方法在功能上是有效的,但外观不佳。随着从肉膜分离获得的岛状皮瓣得以应用,手术可获得极好的功能及外观效果。此外,使用这些皮瓣的时候,我们也要考虑阴茎上毛发的分布和皮瓣转位的力学问题(如,转位和伸展)(图20-32,图20-33)。此外,全厚皮片已用于舟状窝重建,但皮肤移植物用于重建LS导致的狭窄可能是不合适的。前已述及,对于岛状皮瓣用于LS患者仍存在质疑。
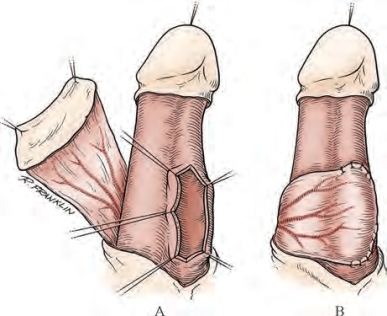
图20-27 阴茎背侧皮肤横向岛状皮瓣用于尿道狭窄修复重建。从肉膜上方获取皮瓣,侧方切开尿道。缝合固定皮瓣(From Jordan GH.Management of anterior urethral stricture disease.ln:Webster GD,editor.Problems in urology.Philadelphia:Lippincott;1987.p.217.)
文献中已说明了镶嵌(onlay)(游离移植物或皮瓣)的成功率高于尿道重建的成功率(Hendren and Crooks,1980)。因此,应尽量不要使用游离移植或皮瓣卷管进行重建。当卷管替代无法避免时,要通过松解或切除的方法控制重建部分的长度。可以明确的是,皮瓣卷管优于游离移植物卷管。前尿道较长段需要重建时,可以在远端使用皮瓣,而在近端使用游离移植物镶嵌(onlay)扩大成形(Wessells et al,1997)。当需要卷管重建时,通过对少量患者的短期随访发现,相较于皮瓣卷管重建,将移植物舒展并固定联合皮瓣镶嵌以重建“尿道板”似乎有更佳的疗效,即使是用于镶嵌-卷管-镶嵌的方法也是如此(Morey,2001)。
近期,Kulkarni等(2012)报道了一期全尿道重建的方法。会阴切开和阴茎折叠后,在近端球部尿道至尿道外口使用背侧游离移植物。平均狭窄长度为14cm,平均随访时间为59个月。总体成功率为83.7%;初次修复成功率为86.5%,尿道成形术失败后再次修复的患者成功率为61.5%。复发部位多数在近端。
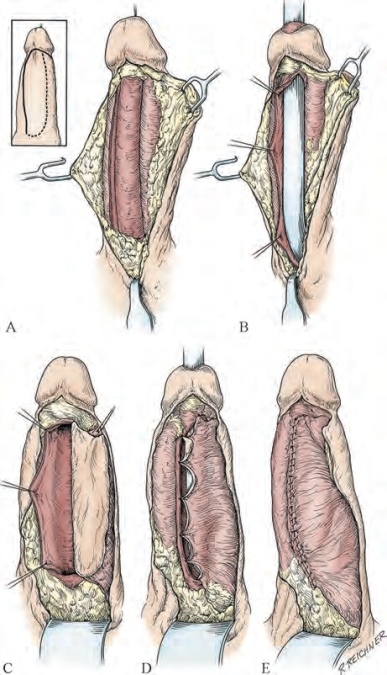
图20-28 阴茎纵行岛状皮瓣。左上小插图展示获取皮瓣的切口位置,沿实线切开肉膜全层和Buck筋膜浅层至尿道海绵体侧方。A.充分分离肉膜,需超过海绵体中线位置。B.对应皮瓣位置,侧方切开狭窄段全长。C.沿虚线(小插图)切开获得皮肤补片,将皮瓣内侧边缘与狭窄切开处边缘缝合。D.翻转皮瓣,覆盖缺损。E.使用可吸收单股缝线连续缝合(From Jordan GH.Management of anterior urethral stricture disease.ln:Webster GD,editor.Problems in urology.Philadelphia:Lippincott;1987.p.214.)
当无法获取无毛发皮肤制作刃厚皮片时,可用去除毛发的阴囊中隔皮瓣作替代。类似于使用刃厚皮片,整个过程需要分期进行,前期应去除毛发。可用细针、单极烧灼针、脱毛针或脱毛机进行。2次脱毛的间期应为6~8周,尿道重建须在最后一次脱毛处理后的10~12周进行。狭窄修复过程实际上包括了阴茎筋膜与阴囊肉膜上的正中岛状皮瓣的获取。一般而言,对于无毛发阴囊岛状皮瓣,不必过分强调皮瓣的修剪。
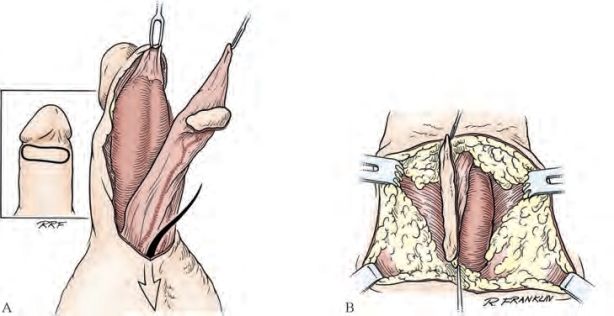
图20-29 腹侧横向岛状皮瓣转移至会阴部,完成皮瓣镶嵌。A.自肉膜表面分离皮肤制备皮瓣。B.皮瓣转移至会阴部修复近端球部尿道狭窄
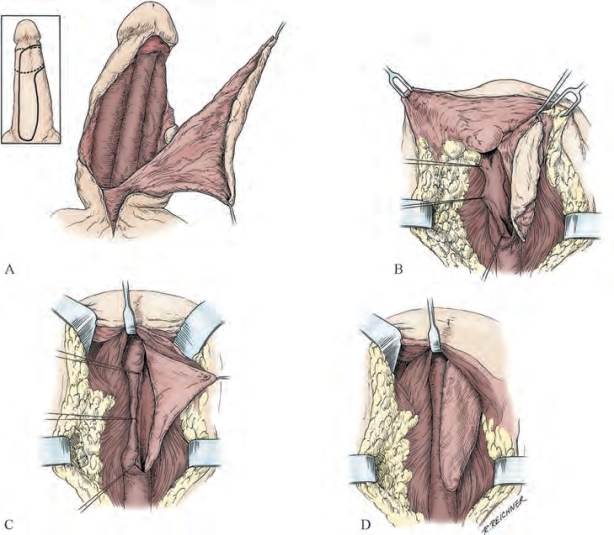
图20-30 用于较长球部狭窄的腹侧岛状皮瓣。该皮瓣取自阴茎腹侧中线部位,可在阴茎远端延伸一周。A.切取皮瓣,皮瓣的蒂包括Buck筋膜和肉膜,剥除阴茎海绵体及尿道海绵体包膜;皮瓣蒂(双侧肉膜)通过其表面的阴部外血管和阴部内血管滋养,蒂的存在使得皮瓣可以转移至尿道的任意位置。B.沿尿道海绵体分离得到阴囊下通道,将皮瓣穿过此通道,在狭窄段做侧方切口。C.固定缝合皮瓣深侧的边缘。D.完成吻合,可见皮瓣蒂在阴囊中伸展(From Jordan GH,McCraw JB.Tissue transfer techniques for genitourinary surgery,part lll.AUA Update Series 1988;7:lesson 11.)
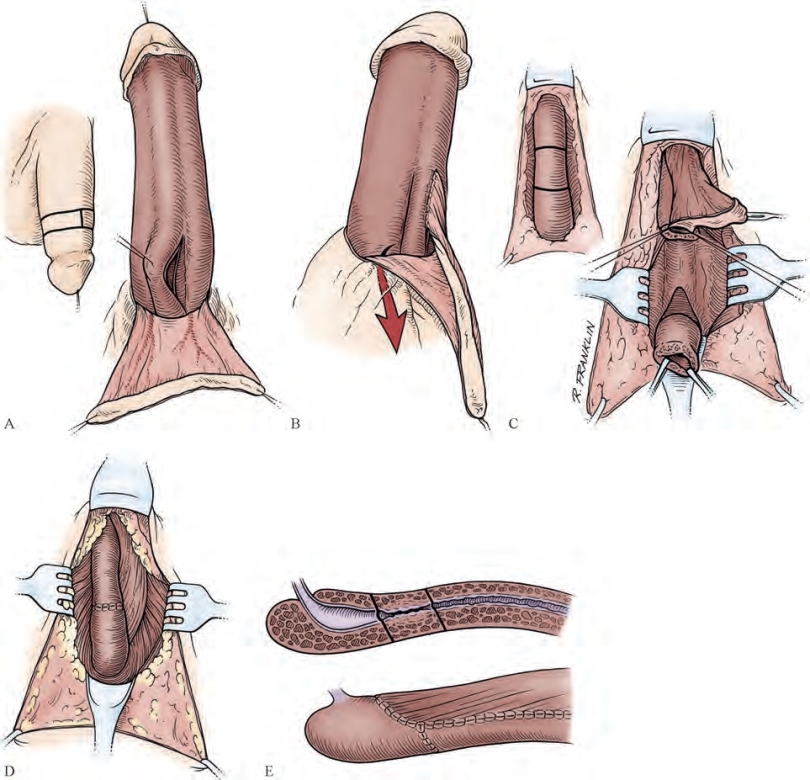
图20-31 长段前尿道狭窄(狭窄环相对较短)修复重建(使用环形岛状皮瓣行扩大吻合术)。A.患者平卧位,于阴茎远端取环形岛状皮瓣。B.开始皮瓣镶嵌,皮瓣置于分离出的会阴间隙,关闭阴茎切口;患者变为截石位。C.于会阴间隙找到皮瓣,切除狭窄环,做尿道背侧切口。D.完成镶嵌,底部条带状吻合已完成。E.术式简图(From Stack RS,Schlossberg SM,Jordan GH.Reconstruction of anterior urethral strictures by the technique of excision and primary anastomosis.Atlas Urol Clin North Am 1997;5:11-21.)
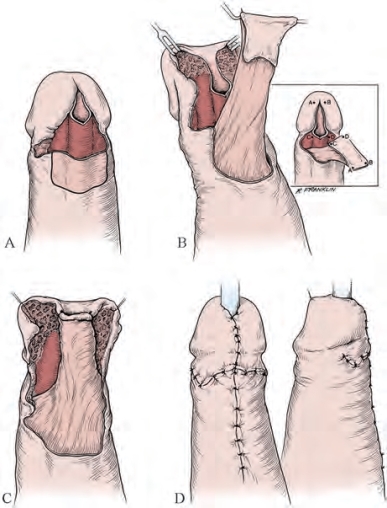
图20-32 舟状窝重建技术。A.显露尿道海绵体腹侧,腹侧切开狭窄段尿道,于阴茎远端标示岛状皮瓣轮廓。B.获取岛状皮瓣。C.将皮瓣移动并翻转至尿道切开处(图B小插图)。D.术毕缝合阴茎切口(A-C,From Jordan GH.Reconstruction of the fossa navicularis.J Urol 1987;138:1210;D,from Jordan GH.Reconstruction of the meatus fossa navicularis using flap techniques.ln:Schreiter F,editor.Plasticreconstructive surgery in urology.Stuttgart:Georg Thieme;1999.p.338-44.)
Mundy(1994)分析了大量尿道重建病例,他的研究数据表明,若随访时间为1年,组织移植成功率为95%;但随着随访时间的延长,这一数字会下降。如果是狭窄部切除并一期吻合,会有更高的1年成功率,且成功率不会随着术后时间的延长而下降。我们已经报道了接受前尿道狭窄切除吻合术的220例前尿道狭窄患者,平均随访时间为44个月,复发3例,其中2例是在术后6个月内复发的,第3例在术后4年复发。患者术后ED发生率为2%,严重的骑跨伤为其危险因素。Wessells和Mc Aninch(1998)进行meta分析后发现,游离移植物镶嵌(onlay)手术与皮瓣手术效果相近,但移植物镶嵌(onlay)在技术上更易操作。也有报道说明皮瓣法重建效果更佳(如放疗后狭窄、多次手术后狭窄、阴茎段狭窄)。但是,随着对移植物重建的应用及认识的加深,现今对前尿道狭窄的规范处理有了更新的要求。此外,移植物镶嵌(onlay)对于前尿道任何部位的狭窄都可应用。专家认为,皮瓣最适用于远端狭窄,而移植物最适于近端狭窄;对于其他部位的狭窄,两者效果相当(Greenwell et al,1999)。
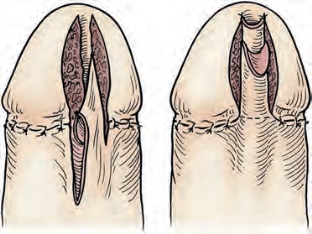
图20-33 来自De Sy的重建技术,使用腹侧纵行岛状皮瓣与尿道切口缝合(From Jordan GH.Management of anterior urethral stricture disease.Probl Urol 1987;1:199-225.)
术后ED的发生也有必要讨论:前尿道吻合重建术后ED的发生率前已引述,Coursey等(2001)分析了200例尿道成形术后的患者,总体而言,术后ED的发生率与包皮环切并无差异。但是,切除的狭窄段尿道越长,术后ED的概率越高;随着时间的推移,许多患者的勃起功能会逐渐改善。
关于LS相关尿道狭窄的修复重建需要专门讨论。随着皮瓣技术的出现,很多医疗中心将这项技术用于此种狭窄的治疗。但是对于一些较大医疗中心患者的治疗结果进行分析显示,该技术应用于LS相关尿道狭窄具有很高的复发率。正因为如此,这些中心已改用分期的游离移植物修复重建(见图20-26)。使用皮瓣的分期手术也有很高的复发率。理论上,因为LS是一种累及皮肤的疾病,将皮肤作为移植物或使用皮瓣均不能避免炎症过程中的皮肤受累(Lee and Phillips,1994;Akporiaye et al,1997)。因此,不少研究中心的术者认为与LS相关的狭窄重建应使用口腔黏膜移植物进行分期重建。短期随访提示这一过程有更高的成功率,尚无长期随访结果的报道。回顾我中心就诊的LS相关舟状窝狭窄的患者,使用腹侧横向皮瓣治疗的复发率为50%(Virasoro et al,2007)。
要点:尿道狭窄的治疗
•在尿道狭窄的治疗中,患者和医师都必须在选择治疗方案前清楚了解治疗目标。
•尿道扩张是治疗尿道狭窄最古老也是最简单的方法。扩张的目的是采取无创的方式牵张瘢痕组织,但扩张不是一种有效的治疗手段。
•尿道内切开术是指任何经尿道腔内切开狭窄部位的操作。手术成功的因素包括:尿道内切开术只应用于尿道球部的狭窄;狭窄长度应<1.5cm,并且狭窄不应与海绵体纤维化有关。很多研究显示,反复扩张和尿道内切开术会降低尿道重建的成功率。
•激光也被广泛用于尿道狭窄的治疗中。到目前为止,采用激光切开尿道狭窄部位的疗效仍不明确。
•尿道狭窄切除吻合术一直被视为治疗前尿道狭窄的金标准。多年后人们发现该术式具有相对局限性,仅适用于不超过1.5~2cm的狭窄。但是随着人们对解剖结构认识的深入,尿道狭窄切除吻合术已能够成功解决更长段的狭窄。
•有些尿道狭窄需要组织移植。目前,游离移植物及皮瓣均已成功应用于临床。Wessells和Mc Aninch(1998)在一篇荟萃分析中指出,游离移植物和皮瓣在尿道重建中的效果是相同的。显然,皮瓣移植的过程要复杂得多。扩大吻合术的概念可以用来描述移植材料和皮瓣的镶嵌。在很多情况下,这种镶嵌的效果要比单纯镶嵌效果更好。皮瓣应用于尿道重建后,形成了统一的概念,但是手术方式却多种多样。
