(七)临床分期
GCT的预后和初始管理决策取决于疾病的临床分期。临床分期是根据原发肿瘤的组织病理学分型和病理分期、睾丸切除术后检测的血清肿瘤标志物水平、是否存在体检和分期影像学所确定的转移性病灶及其程度。1997年,美国癌症联合委员会(AJCC)和国际癌症研究联盟(UICC)制订了GCT分类的国际共识分类(表14-1)。AJCC和UICC分期系统独一无二,因为其首次基于睾丸切除术后AFP、h CG和LDH水平的血清肿瘤标志物类别用于补充基于疾病解剖范围所确定的预后分期。AJCC和UlCC分期系统在2002年进行了更新,新系统将在原发性肿瘤中出现淋巴血管浸润(LVl)视为以另一种器官局限性肿瘤形式存在的p T2。临床Ⅰ期被定义为临床上病变局限于睾丸,临床Ⅱ期被定义为存在区域(腹膜后)淋巴结转移,临床Ⅲ期被定义为存在非区域淋巴结和(或)内脏转移。
1.影像学分期研究
GCT遵循一种可预测的模式转移扩散,这有助于其成功治疗。除绒毛膜癌以外,最常见的病变扩散途径是通过淋巴管从原发肿瘤转移到腹膜后淋巴结并随后扩散到远处。绒毛膜癌有血行播散的倾向。腹膜后是70%~80%的GCT患者最初的转移扩散部位。腹膜后淋巴结清扫术(retroperitoneal lymph node dissection,RPLND)的系列详细定位研究增加了对睾丸淋巴引流的理解,并确定了最可能的转移扩散部位(Sheinfeld,1994)。对于右侧睾丸肿瘤,最初引流部位是肾血管下方的主动脉下腔静脉间淋巴结,随后是下腔静脉旁和主动脉旁淋巴结。左侧睾丸肿瘤的最初“着陆区”是主动脉旁淋巴结,其次是主动脉下腔静脉间淋巴结(Donohue et al,1982)。腹膜后淋巴引流的模式是从右向左。从初始“着陆区”向对侧传播在右侧肿瘤中很常见,但在左侧肿瘤中很少见,并且通常见于大体积肿瘤病变。转移性病变出现在骶尾部表明可能有巨大病变侵犯远端髂骨和腹股沟淋巴结逆行转移,也有可能是更罕见的异常睾丸淋巴引流。腹膜后淋巴随后流入右肾动脉和右膈脚后面的乳糜池。腹膜后淋巴转移的患者其影像学上可能显示膈脚后间隙淋巴结的转移。从该处,淋巴通过胸导管转移到后纵隔和左锁骨上窝。
(1)腹部和盆腔的临床分期:所有GCT患者均应进行腹部和盆腔的分期影像学检查。计算机断层扫描(CT)成像加上口服或静脉内注射造影剂是腹膜后和盆腔分期最有效的无创影像学检查手段。CT还提供了对腹膜后的详细解剖评估,以识别可能使后续的RPLND复杂化的解剖异常,如回旋主动脉或腹主动脉之后的左肾静脉、下极肾动脉或腔静脉后右侧输尿管。磁共振成像(MRI)是CT的替代方案,尽管MRI需要更长的检查时间、更高的成本和更低的普及性。
10%~20%的精原细胞瘤和60%~70%的NSGCT在CT上可发现增大的腹膜后淋巴结。腹膜后是临床分期最困难的区域。尽管在过去的40年中CT有所改善,但仍有25%~35%CT结果显示阴性的临床Ⅰ期NSGCT患者,其病理检查显示腹膜后淋巴结阳性(Fernandez et al,1994)。关于腹膜后淋巴结大小的“正常”CT标准尚没有共识。通常使用10mm来区分肿大的淋巴结,但是该尺寸标准据报道有高达63%的假阴性率。在临床ⅡA和ⅡB期疾病的患者中,12%~40%的患者CT报告了过度的临床分期(即RPLND的病理学阴性而CT上显示腹膜后淋巴结增大)。
理解左侧和右侧肿瘤的初始引流部位能够使我们通过降低最初着陆区中临床阳性淋巴结的大小标准来增加腹部盆腔CT扫描的敏感性。Leibovitch及其同事(1995a)的研究表明,在初始着陆区以4mm和该区域以外10mm作为区分阈值,其病理Ⅱ期疾病的敏感性和特异性分别为91%和50%。在一项类似的研究中,Hilton及其同事(1997)报道,对最初着陆区的淋巴结使用4mm的区分阈值其敏感性和特异性分别为93%和58%,他们选择的区域位于主动脉分叉水平的前方。根据这一证据,初始着陆区5~9mm大小的腹膜后淋巴结应该怀疑为区域淋巴结转移,尤其是如果它们在横断面影像上位于大血管的前方(图14-3)。鉴于GCT快速生长的特点,建议应基于治疗开始4周内的CT结果制定肿瘤管理决策。
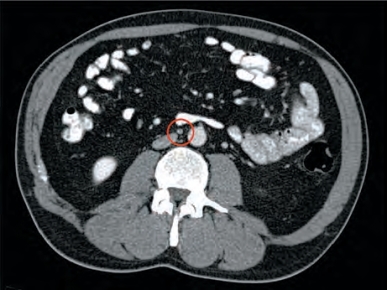
图14-3 右侧睾丸NSGCT患者在睾丸切除术后所显示的腹部盆腔CT扫描图像。该图像显示在初始侵袭区域中有7mm大小的淋巴结。在行腹膜后淋巴结清扫后证实该淋巴结为畸胎瘤转移灶
恶性GCT会聚积氟脱氧葡萄糖(FDG),多项研究调查了正电子发射断层扫描与FDG(FDG-PET)在GCTs诊断分期和化疗后反应评估方面的价值。几项小型试验研究表明,FDGPET能比CT更精确地鉴别早期精原细胞瘤和NSGCT腹膜后转移(Albers et al,1999)。在一项对111例临床Ⅰ期NSGCT患者的FDG-PET进行集中审阅的前瞻性试验中,87例PET阴性患者中有33例复发,评估无复发率为63%(Huddart et al,2007)。研究者得出结论:FDG-PET对临床Ⅰ期NSGCT分期的准确性不够高。de Wit及其同事(2008)也报道作为早期NSGCT主要分期工具,FDG-PET的结果仅比CT略好。FDGPET目前在诊断时不用于常规评估NSGCT和精原细胞瘤。
根据腹部盆腔成像,以区域淋巴结大小,我们把临床Ⅱ期分为ⅡA(增大的腹膜后淋巴结≤2cm)、ⅡB(增大的腹膜后淋巴结>2cm但≤5cm)和ⅡC(增大淋巴结>5cm)。
(2)腹部和盆腔的病理分期:在某些欧洲医学中心开展的开放RPLND手术和大多数腹腔镜RPLND系列研究中,在临床Ⅰ期或ⅡA期NSGCT患者中进行RPLND主要是为了分期而非达到根治的目的,根据区域淋巴结情况确定是否需要后续化疗(Nelson et al 1999;Janetschek et al,2000;Albers et al,2003;Bhayani et al,2003;Nielsen et al,2007;Albers et al,2008)。病理N分期与临床N分期不同,前者考虑淋巴结转移的数目:p N0,无区域淋巴结转移;p N1,5个或少于5个淋巴结并且不超过2cm;p N2,涉及5个以上的淋巴结和(或)任何一个淋巴结2~5cm;p N3,任何一个淋巴结>5cm。Ⅱ期病变患者(p Tany,p N1-3,M0)隐匿性转移及RPLND后复发的风险与区域淋巴结转移负荷密切相关(p N1的10%~30%与p N2~3的50%~80%)。病理性N分期不适用于既往化疗患者的RPLND标本。
2.胸部成像
所有GCT患者在做出治疗决策之前都应进行胸部影像学检查。若无腹膜后病变和(或)血清肿瘤标志物升高,胸部转移并不常见,特别是对于精原细胞瘤。常规胸部CT检查可能假阳性率高,这或许会使随后的治疗复杂化(Horan et al,2007)。在诊断时作为初步分期,采用胸部X线平片检查是合理的;CT检查应在睾丸切除术后血清肿瘤标志物升高的患者中进行,或者在体检或腹部盆腔CT显像发现有转移性病变,或者胸部X线平片影像存在异常或可疑病变的患者中进行。对淋巴血管浸润或EC占主导的临床Ⅰ期NSGCT患者进行胸部CT定位可能是合理的。一些研究报道,在腹膜后CT扫描阴性时肺内血源性转移的比例很高(Hermans et al,2000;Sweeney et al,2000)。无腹膜后病变的纵隔或肺门淋巴结病变应高度怀疑非GCT疾病,如淋巴瘤或结节病,并且应在开始全身治疗前通过纵隔镜检查和活检进行组织学确认(Hunt et al,2009)。
在无临床症状或其他相关临床指标阳性的GCT患者中,骨和脑的脏器转移并不常见。在诊断时,常规骨显像或头颅CT成像没有意义。一个值得注意的例外是,对于hCG高度升高(>10 000m U/ml)的患者应进行头颅CT成像,因为这种水平往往与转移性绒毛膜癌相关联,后者倾向于脑转移。(https://www.daowen.com)
3.血清肿瘤标志物
睾丸切除术后测定的AFP、hCG和LDH水平对于分期、预后和治疗选择很重要。所有术前血清肿瘤标志物水平升高的患者均应在睾丸切除术后抽取血清肿瘤标志物,以根据半衰期及睾丸切除术前水平评估其合理的下降。睾丸切除术后血清肿瘤标志物水平新的升高和(或)持续增高表明存在转移性病变,这些患者应接受诱导化疗。在转移性评估阴性和标志物下降缓慢的情况下(即不符合半衰期)时,应对患者进行密切监测并定期检查其血清肿瘤标志物水平,直到恢复正常或开始升高。略高于正常范围的稳定AFP或hCG水平应谨慎解释,其他导致血清肿瘤标志物升高的原因应在治疗决策前排除。与分期影像学检查一样,治疗决策应基于治疗开始后4周内测量的血清肿瘤标志物水平。
4.四期生殖细胞肿瘤的预后分类
一项对1975-1990年期间用含铂化疗方案(顺铂或卡铂)治疗的5202例晚期NSGCT患者的国际回顾性汇总分析把化疗开始时的AFP、hCG和LDH水平、是否存在肺外内脏转移和原发性纵隔NSGCT作为疾病进展和存活的重要和独立预后因素(International Germ Cell Consensus Classification,1997)。在660例晚期精原细胞瘤患者中,只有肺外内脏转移的存在是肿瘤进展和存活的重要预测因子(International Germ Cell Consensus Classification,1997)。
基于这些分析,开发了用于晚期GCT的国际生殖细胞癌协作组(lGCCCG)风险分类(表14-2)(International Germ Cell Consensus Classification,1997)。lGCCCG风险分类应针对每个转移性GCT患者确定,并且应该用于指导化疗选择的治疗决策(稍后讨论)。这种分类仅适用于诊断时为晚期GCT而不适用于复发的GCT患者。也是基于睾丸切除术后化疗开始时而非术前的肿瘤标志物水平。
表14-2 国际生殖细胞癌协作组对晚期生殖细胞肿瘤的风险分类

(续 表)

AFP.甲胎蛋白;hCG.人绒毛膜促性腺激素;LDH.乳酸脱氢酶;PFS.无进展生存率
From International Germ Cell Consensus Classification:a prognostic factor-based staging system for metastatic germ cell cancers.International Germ Cell Cancer Collaborative Group. J Clin Oncol 1997;15:594-603.
根据IGCCCG标准,大约56%的晚期NSGCT患者被划分为低危,28%为中危,16%为高危,这三类患者的5年无进展生存率和总生存率分别为89%和92%(低危)、75%和80%(中危)、41%和48%(高危)。精原细胞瘤没有高危类别。约有90%和10%的晚期精原细胞瘤患者根据IGCCCG标准分为低危和中危,这些患者的5年无进展生存率和总生存率分别为82%和86%(低危)和67%、72%(中危)。Van Dijk及其同事(2006)发表了一项对1989年以后接受NSGCT治疗的1775例NSCLC患者(10项研究)的荟萃分析,并报道了合并的5年生存率估计值为94%(低危)、83%(中危)和71%(高危)(按IGCCCG标准)。这些结果显示,与原始研究相比,生存率明显改善(特别是对于风险较低的患者),这归因于更有效的治疗和治疗NSGCT患者的更多经验。
TNM系统在睾丸癌分期中包含肿瘤标记物水平(S0-3)和肺外转移。然而,该系统没有考虑精原细胞瘤及NSGCT伴肺外转移之间预后的差异。在TNM系统中,这两个实体瘤都被划分为ⅢC阶段,但IGCCCG将前者归类为中危,后者归类为高危。IGCCCG系统优先用于预后评估和化疗的选择。
5.精子冷冻保存
虽然不育症是GCT的一种不常见表现,但诊断时高达52%的男性患有少精子症,而10%为无精子症(Williams et al,2009a)。现有的有限数据表明,大约一半的男性在睾丸切除术后精液指标恢复正常(Carroll et al,1987;Jacobsen et al,2001)。生精上皮对基于铂的化疗和放疗非常敏感。几乎所有的患者在化疗后都会出现无精子症,初诊时精液参数正常的患者有50%和80%分别在2年和5年内精液恢复到正常水平(Bokemeyer et al,1996a;Feldman et al,2008)。精原细胞瘤放疗后精子发生的恢复可能需要2~3年或更长时间(Fossa et al,1999b)。RPLND可能导致80%或更多的患者发生射精功能障碍,尤其是经历过完全双侧清扫而无保留神经的患者。大多数男性能够在GCTs的标准化疗后生育后代;放疗似乎比化疗对生育有更多的不利影响(Huyghe et al,2004)。考虑到睾丸癌治疗对生育力的影响,建议在治疗开始前对尚未决定是否生育或未来有生育计划的男性进行精子冷冻保存。精子保存可以在根治性睾丸切除术之前或之后完成。
