解剖学和病理学
熟悉尿道解剖对于手术切除和重建很重要。女性尿道分为前部(远端1/3)和后部(近端2/3)。远端1/3可以被切除并保留尿控。近端1/3尿道为典型的移行尿道上皮细胞覆盖,而远端2/3由复层鳞状上皮覆盖(图18-9)。沿其全长是柱状上皮构成的黏膜下腺体。如同男性,女性尿道淋巴回流随位置不同而变化。其中虽然可能存在交叉和交通支,但是后尿道淋巴主要回流至髂外、髂内和闭孔淋巴结,前尿道和阴唇淋巴回流至腹股沟浅淋巴结,然后回流至腹股沟深淋巴结(Carroll and Dixon,1992)。
恶性肿瘤的组织学形态主要依赖于尿道内的原发部位(见图18-9)。由于纳入患者人数较少且数目变异较大,不同研究报道的尿道癌主要组织学类型不尽相同。通常认为,鳞状细胞癌是最常见的组织学形态,见于30%~70%的患者。其次为移行细胞癌和腺癌(各占10%~25%)。Swartz对SEER数据的回顾性分析发现,略占多数的尿道肿瘤为移行细胞癌,而且在女性中,移行细胞癌、鳞癌、腺癌分别占30%、28%和29%。
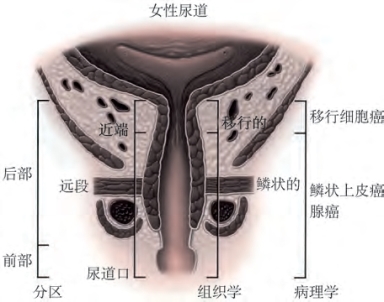
图18-9 女性尿道解剖和相应的组织学和病理组织学
一项来自“荷兰国家癌症档案”的研究证实了SEER的数据,并且显示女性尿道肿瘤最主要的细胞类型为移行细胞癌(Derksen et al,2013)。这项研究包含了91例女性原发尿道肿瘤患者,显示移行细胞癌占45%,鳞癌占19%,腺癌占29%。
其他较罕见的细胞形态包括淋巴瘤、神经内分泌瘤、肉瘤、副神经节瘤、黑色素瘤和转移瘤(Johnson and O’Connell,1983;Grabstald et al,1966;Foens et al,1991;Forman and Lichter,1992;Grigsby and Herr,2000;Swartz et al,2006)。在尿道憩室中,腺癌的发生率似乎有所升高,证实了一些女性的尿道憩室可能起源于腺体来源的理论,如源于尿道旁腺(Spencer et al,1990;Rajan et al,1993;Gheiler et al,1998;Thomas et al,2008;Reis et al,2011)。
1.诊断和分期
对可疑尿道肿瘤女性患者的评估包括彻底的盆腔检查,评估阴道前方可触及的肿块以辨别是尿道憩室、尿道癌、尿道息肉或其他良性肿瘤,如平滑肌瘤。窥阴器检查应该直视尿道外口,并且评估包括阴道前壁、外阴在内的可能侵犯的范围。诊断性检查包括麻醉下膀胱镜检查。MRI可用来评估盆腔肿块,因为其在软组织对比方面优于CT并且能够最好地显示局部解剖的细节。此外,MRI能够评估局部浸润及淋巴结的转移。可另行胸部X线或CT评估分期。当出现骨骼症状,或实验室检查提示碱性磷酸酶或血清钙异常升高,应临床怀疑骨转移可能,可行骨扫描检查。尽管其在尿道癌方面实用性并未准确定义,正电子发射断层摄影术(PET/CT)可能对转移癌患者有用。在一个包含少数女性腺癌患者的报道中,发现血清PSA升高,并且似乎只有少数女性原发尿道腺癌患者该项肿瘤标志物升高(Dodson et al,1994;Pongtippan et al,2004)。女性尿道癌的TNM分期与男性类似(见表18-1)。临床上总体高达30%的患者可以触及腹股沟淋巴结,其中约90%被确诊为恶性。50%患有近端尿道癌或进展性尿道癌的患者可触及淋巴结。盆腔淋巴结转移病例也较常见,约占20%。然而盆腔外的远处转移罕见,在随访中,另有15%的患者发展为远处淋巴结转移(Grigsby and Herr,2000)。
2.治疗和预后
由于这种肿瘤的罕见性和异质性,任何单一研究机构都没有充足的经验,以至于无法有效确定这种自然疾病史、推荐治疗及随访建议(Grigsby and Herr,2000)。虽然不同的组织亚型可能会影响预后及疾病远处转移倾向,但是多数研究未能根据组织亚型发现生存率的不同(Foens et al,1991;Dimarco et al,2004)。因此,不同组织亚型的病变其治疗方法常常类似。最近对359名女性患者的SEER数据的生存分析发现,鳞状细胞癌较移行细胞癌或腺癌有更长的肿瘤特异性生存率(风险比分别为2.03和1.90)(Champ et al,2012)。
治疗方案主要根据肿瘤位置和临床分期。局部切除可以维持良好功能,适用于相对少见的体积小、浅表性的远端尿道肿瘤。对于近端和进展期的尿道肿瘤,需要行更积极的治疗方法。与近端尿道癌相比,远端病变可获得更好的生存率。远端病变的疾病5年特异性生存率为71%,近端病变为48%,侵犯尿道大部的病变为24%(Dalbagni et al,1998)。手术结合放疗的5年生存率为30%~40%。不幸的是,对于此疾病的治疗目前几乎没有进展,生存率在近50年没有统计学上的改变(Bracken et al,1976;Prempree et al,1984;Foens et al,1991;Dalbagni et al,1998;Dimarco et al,2004)。
在一项对1983-2008年间722例女性原发性尿道癌患者的SEER数据研究中,359例无转移病变的患者有足够的数据来评估癌症的生存状况(Champ et al,2012)。结果显示,5年和10年的总体生存率分别为43%和32%,肿瘤特异性5年和10年生存率分别为53%和46%。多元分析显示,种族(非裔美国人)、肿瘤晚期、接受手术时淋巴结阳性、非鳞状细胞癌、老龄这些因素与更差的肿瘤特异性生存率有关。手术能够提高生存率,而放疗不能,但这些数据并不能证明放疗没有获益,因为选择偏倚和其他混杂因素明显影响了研究结果。
另有一项来自“荷兰国家癌症档案”的研究数据,该研究包含了91例女性原发性尿道癌患者,其中46%的患者为晚期(Ⅲ期或Ⅳ期),0期至Ⅱ期、Ⅲ期和Ⅳ期的5年生存率分别为67%、53%和17%(Derksen et al,2013)。
治疗女性尿道癌的方法包括单独或联合使用手术、放疗和化疗。基于先前的一些报道结果,近年来治疗手段趋于综合治疗。与男性尿道癌相比,放疗的使用率有所增加。在Champ及其同事对SEER数据的研究中,72%的患者接受了相关的手术治疗,42%的患者接受了放疗。来自“荷兰国家癌症档案”的研究数据显示,43%的患者接受了手术治疗,16%的患者接受了放疗,22%的患者接受了手术加放疗(Derksen et al,2013)。这些结果虽然来自不同研究、不同治疗手段和不同随访组,但是这些系列研究报道了主要的治疗方法,每种治疗的人数均多于2例,表18-2、表18-3分别总结了早期和进展期疾病。
表18-2 女性尿道癌早期的不同治疗方法与结果
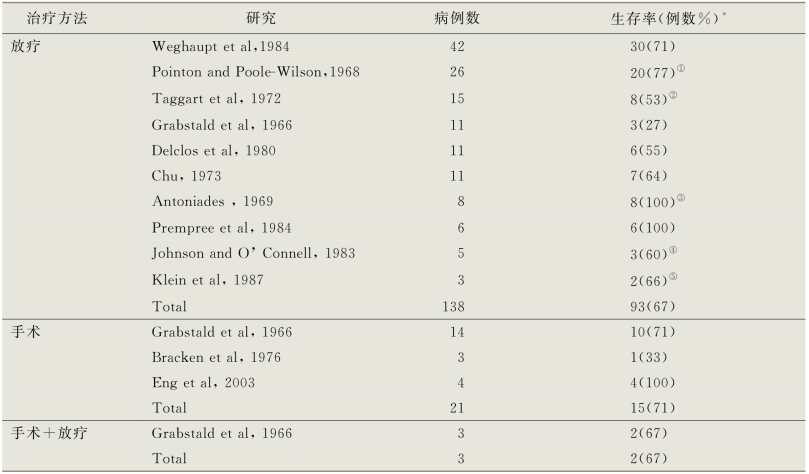
*如无说明则为5~6年生存率
①3年生存率
②2年无病生存率
③1名患者64个月死亡
④4年无病生存
⑤27~37个月生存
表18-3 女性尿道癌进展期的不同治疗方法与结果
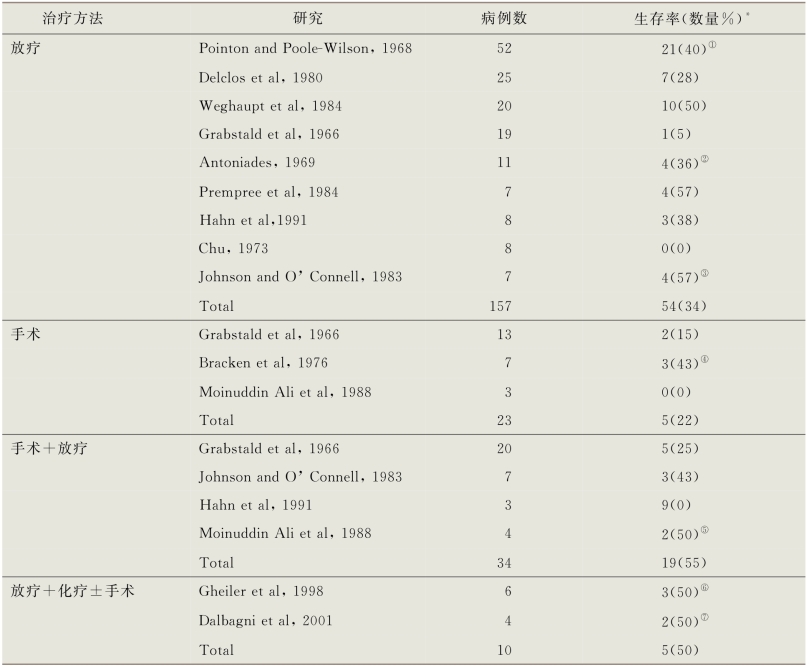
*如无说明则为5~6年生存率
①3年生存率
②2例患者因此病治疗8年和21年死亡
③1、1、3和6年无病生存
④2个月及3、8、12年无病生存
⑤48个月生存
⑥6个月和4年无病生存
⑦1.5和4年无病生存
3.女性远端尿道癌
来源于尿道外口或者远端1/3尿道、体积小、外向生长的表浅肿瘤可以通过经阴道远端尿道环切及切除部分阴道前壁来治疗。手术中获取近端尿道标本的冰冻切片以保证足够的切缘(Narayan and Konety,1992)。文献描述了采用激光凝固小体积远端肿瘤的方法(Staehler et al,1985;Dann et al,1989)。在特定的T2或T3期患者中,如果肿瘤更靠前端并且在保证彻底切除病变的情况下,可以选择保留膀胱的策略。Dimarco及其同事描述了女性患者的根治性尿道切除术,切除范围应至膀胱颈部,并包括广泛的尿道周围组织和阴道前壁。尿流改道通过囊性流出道(回肠或阑尾膀胱造口术)连接膀胱及腹壁完成。远端尿道肿瘤趋于低分期,单纯局部切除治愈率为70%~90%。然而Dimarco及其同事研究报道(2004),21%的T2期或更低分期的肿瘤患者采用尿道部分切除术后发生局部复发。其他采用单纯尿道部分切除术或联合放疗的低分期病变的复发率为0~50%(Hahn et al,1991;Gheiler et al,1998)。尿道口狭窄是常见的并发症,可以通过将尿道口切开降低其发生率。虽然术中将阴道前壁和阴唇缩近缝合可以防止尿失禁,但最终可能还是需要采用吊带或其他措施治疗尿失禁。虽然许多学者报道尿道部分切除术并发症少,尿失禁很少发生,但有研究表明42%的患者术后新发生压力性尿失禁或原有的尿失禁症状加重(Dimarco et al,2004)。
放疗和手术治疗已证明对远端低分期的尿道癌有效。Garden和同事报道了84例患者的5年生存率为41%(1993)。尿道部分侵犯组5年生存率为74%,尿道整体侵犯组5年生存率为55%。生存率与肿瘤的临床分期相关(Garden et al,1993)。放疗可以通过外照射放疗、近距离放疗或两者联合进行。在Iowa大学治疗的42例患者中,对比所有患者放疗的局部失败率(36%)和单纯手术治疗的局部失败率(60%),采用联合体内和体外放疗方法的局部失败率较低(14%),而采用放疗和手术治疗的5年生存率类似(Foens et al,1991)。虽然放疗采用的剂量差别很大,多数采用了55~70Gy的剂量。并发症发生率目前已下降,为20%~40%,包括尿失禁、尿道狭窄、尿道坏死、瘘管形成、膀胱炎、阴唇脓肿和蜂窝织炎(Forman and Lichter,1992)。对于女性患者,当手术切除对功能保留产生不良影响时,放疗可以作为另一选择。淋巴结清扫发现,髂腹股沟淋巴结受累发病率高。另外,女性尿道癌在系统转移时通常无局部淋巴结侵犯。虽然研究病例较少,但没有证据显示行腹股沟或盆腔淋巴结切除术能够提高生存率(Grabstald et al,1966;Levine,1980;Dimarco et al,2004)。由于这些情况和无法预知淋巴结微转移,目前不推荐采用预防性和诊断性淋巴结切除术。由于没有足够客观数据用于确定治疗方法,淋巴结切除仅推荐用于腹股沟或盆腔淋巴结阳性、没有远处转移的患者,或在随访时发现局部腺性病变的患者。目前已发现有术后7年淋巴结复发的病例。髂腹股沟淋巴结切除术的方法与男性阴茎癌行淋巴结切除术时完全相同(Narayan and Konety,1992;Grigsby and Herr,2000)。
对于复发和肿瘤放疗抵抗的患者,新辅助放疗后行局部切除术的生存率优于单一放疗(Grabstald et al,1966;Peterson et al,1973;Allen and Nelson,1978)。即使对前尿道病变采用早期和积极的治疗,局部复发率和死亡率仍很高。因此,需要进一步研究,评估多种疗法对这种患者的作用。
4.女性近端尿道癌(https://www.daowen.com)
女性近端尿道癌更趋于高分期,并且可能侵犯膀胱和阴道。单纯手术切除后的5年生存率为10%~17%,局部复发率为67%(Bracken et al,1976;Klein et al,1983)。由于单一手段治疗晚期女性尿道癌的疾病特异性生存率低和局部复发率高,因此推荐联合治疗模式(Dalbagni et al,1998,2001;Gheiler et al,1998)。晚期女性尿道癌包括肿瘤位于近端、病变包括整个尿道,或局部浸润性病变侵犯外生殖器、阴道或膀胱。前盆腔脏器切除术(膀胱尿道切除术)、盆腔淋巴结切除术、广泛阴道或阴道全切术通常被采用以保证手术切缘阴性。如果病变侵犯外生殖器,可能需要行外阴部分切除术和阴唇切除术。前盆腔脏器切除术的方式如同处理女性膀胱癌患者一样,同时还需要更广泛的处理会阴部位,从而使尿道周围手术范围更广。淋巴结切除术的范围远端包括Cloquet淋巴结,其余切除范围和膀胱癌淋巴结切除术相同。前盆腔脏器切除术包括整体切除膀胱和尿道、子宫和附件、阴道前壁和侧壁。有时也需要切除整个阴道。会阴部先环绕尿道口行倒“U”形切口,切口推荐延长至阴道后壁至小阴唇,然后向前包括或超过阴蒂(Narayan and Konety,1992)。尽管对于疑似侵犯的病例,在术中加用放疗的情况下,行骨切除术以确保长期局部控制的必要性受到质疑,但如果病变向前侵犯耻骨,整个耻骨联合及耻骨下支可能仍有切除的必要(Dalbagni et al,2001)。
对于浸润性近端尿道癌,采用单一放疗局部控制效果较差,报道的5年生存率为0~57%(Grabstald et al,1966;Johnson and O’Connell,1983;Prempree et al,1984;Narayan and Konety,1992)。对高分期疾病,联合放疗和手术治疗可使5年生存率提高达到54%(Moinuddin Ali et al,1988;Terry et al,1997)。
晚期女性尿道癌推荐联合放疗、化疗和手术治疗,以获得理想的局部和远处控制。治疗失败的患者被认为在初次治疗时已有微转移。部分由于5-氟尿嘧啶+丝裂霉素C在直肠癌治疗中的有效性,该方案最常用于鳞状细胞癌患者(Kalra et al,1985)。对于移行细胞癌患者,推荐使用M-VAC方案(甲氨蝶呤、长春新碱、阿霉素和顺铂)或者吉西他滨方案(Grigsby and Herr,2000)。化疗辅助放疗可以影响细胞修复,从而起到放射增敏剂的作用。人们希望通过这种方法能够消除微转移灶,以减少局部复发并增加生存率,从而防止由局部治疗失败发展到系统性治疗失败。Memorial Sloan-Kettering医疗小组对6例晚期近端尿道癌患者采用多模式治疗,并得到初步的结果。作者建议,前盆腔脏器切除术中采用高剂量近距离放疗,后续联合体外放疗,似乎能增强局部控制,但仍需进一步研究,以评估联合治疗是否可以减少远处转移和提高生存率(Dalbagni et al,1998,2001)。
对于晚期女性尿道癌,我们建议对局部晚期肿瘤行初始化疗和(或)放疗。如果影像学及内镜检查确认肿瘤得到控制,可以考虑手术巩固治疗。全身化疗用于转移性患者。
5.女性膀胱切除术后尿道复发
原位新膀胱术是目前女性因移行细胞癌行根治性膀胱切除术后尿流改道的标准术式。膀胱癌行膀胱切除术的女性患者中发现1%~13%累及尿道(Coloby et al,1994;Stein et al,1995,1998;Stenzl et al,1995)。侵犯膀胱颈是否是原位膀胱重建的禁忌证,目前仍有争论。一项前瞻性研究表明,尽管该试验所纳入的所有膀胱切除术的最终病理证实的尿道移行细胞癌患者均显示膀胱颈累及,但是超过60%膀胱颈累及的膀胱癌患者没有证据表明尿道移行细胞癌存在(Stein et al,1998)。因此,一些学者推荐术中对尿道残端做冰冻切片分析,用于判断行保留尿道的膀胱切除术和原位膀胱重建术的可行性(Stein et al,1998)。
要点:女性尿道癌
•女性尿道癌常见的3种组织类型为移行细胞癌、鳞状细胞癌和腺癌,分别约各占30%。
•与近端尿道癌相比,远端尿道病变生存率较高。
•远端尿道癌趋于低分期,单纯行经阴道局部切除术的治愈率为70%~90%。当手术切除对功能产生不良影响时,可选择放疗。
•女性近端尿道癌更多是高分期,可侵犯膀胱和阴道。
•女性尿道癌晚期患者的最佳治疗方法尚不确切。提倡多模式治疗,联合化疗、放疗和手术治疗被推荐用于局部和远处病变的控制。
•选择在合适的女性膀胱癌患者中行膀胱根治性切除术及原位膀胱术,尿道残端很少癌症复发。
尽管有报道膀胱切除术患者发生尿道受累和女性更多地采用原位膀胱手术,但很少有病例报告在接受这一手术后发生尿道恶性肿瘤的情况。南加州大学单中心报道1054例行根治性膀胱切除术,其中位随访时间为10年,女性患者211例,其中44例行原位膀胱重建,无1例尿道复发(Clark et al,2004)。随后,此研究小组报道了他们首例女性患者原位膀胱术后原位尿道复发的病例,该患者接受了全尿道切除、原位新膀胱颈切除,并将原位储尿囊转为可控皮肤造口尿流改道,术后随访4年未见复发证据(Stein et al,2008)。在安德森癌症中心的Taylor及其同事(2009)的一项报道中,纳入260例膀胱根治性切除术+原位膀胱术的患者,其中10例为女性,共有6例尿道复发,且均为男性。Ali-el-Dein及其同事(2004)的一项研究表明,145例行原位膀胱术的女性患者中,61%为鳞状细胞癌,21%为移行细胞癌,中位随访时间为56个月,2例患者(1.4%)发生局部尿道复发,1例患者无手术指征,另1例行尿道切除及转为可控皮肤造口后8个月死亡(Ali-el-Dein et al,2004)。另一项报道描述了1例女性患者原位膀胱重建术后发生尿道移行细胞癌,此患者为高级别膀胱基底部肿瘤伴有淋巴结转移,最初采用化疗,随后行尿道切除术和转为可控皮肤尿流改道术,术后5个月因发生内脏器官转移死亡(Jones et al,2000)。由于目前经验有限,对原位膀胱重建术后尿道癌复发的女性患者没有确切的可推荐治疗方案。对于没有转移的患者,行尿道切除术及切除尿道膀胱吻合处,同时转变为可控皮肤尿流改道术是可行与合理的。使用原有改道肠管行皮肤尿流改道是另一种可选择的方式(Bissada et al,2004)。
参考文献
完整的参考文献列表通过www.expertconsult.com在线获取。
推荐阅读
Clark PE,Stein JP,Groshen SG,et al.The management of urethral transitional cell carcinoma after radical cystectomy for invasive bladder cancer.J Urol 2004;172:1342-7.
Cohen MS,Triaca V,Billmeyer B,et al.Coordinated chemoradiation therapy with genital preservation for the treatment of primary invasive carcinoma of the male urethra.J Urol 2008;179:536-41.
Dalbagni G,Donat SM,Eschwege P,et al.Results of highdose rate brachytherapy,anterior pelvic exenteration and external beam radiotherapy for carcinoma of the female urethra.J Urol 2001;166:1759-61.
Dayyani F,Pettaway CA,Kamat AM,et al.Retrospective analysis of survival outcomes and the role of cisplatinbased chemotherapy in patients with urethral carcinomas referred to medical oncologists.Urol Oncol 2013;31:1171-7.
Dimarco DS,Dimarco CS,Zincke H,et al.Surgical treatment for local control of female urethral carcinoma.Urol Oncol 2004;22:404-9.
Grivas PD,Davenport M,Montie JE,et al.Urethral cancer.Hematol Oncol Clin North Am 2012;26:1291-314.Karnes RJ,Breau RH,Lightner DJ.Surgery for urethral cancer.Urol Clin N Am 2010;37:445-57.
Rabbani F.Prognostic factors in male urethral cancer.Cancer 2011;117:2426-34.
(张卫星 李 腾 编译 周 梁 潘 峰田 龙 审校)
