(三)精子发生
精子发生是一个非常复杂和特化的DNA减少和生殖细胞变形的过程。早期研究显示,人类生精的整个过程大约需要64d(Clermont,1972)。然而,健康男性的体内动态研究显示,生成可射出精子的总时间为42~76d,表明精子发生的持续时间,可在个体间存在很大差异(Misell et al,2006)(图2-13)。精子发生过程:①增殖期,精原细胞分裂以维持数目(自我更新)或分化为子细胞再转变为成熟配子;②减数分裂期,生殖细胞分裂时DNA数量减少,生成单倍体(正常DNA的一半)精子细胞;③精子形成期,精子细胞经历明显的变形成为成熟精子。[关于此内容的精彩论述请参阅Steinberger(1976)和de Kretser和Kerr(1988)]。如果在单个固定时间点观察生精小管内的精子发生,可观察到6个可识别的细胞阶段(Heller and Clermont,1964)(见图2-11)。此外,生精小管内还存在一种对生精周期的特殊调控,称为生精波。确凿证据表明,人类精子发生以螺旋或螺旋细胞排列的形式存在,以确保精子生成是连续过程而不是脉冲过程(Schulze,1989)(图2-14)。
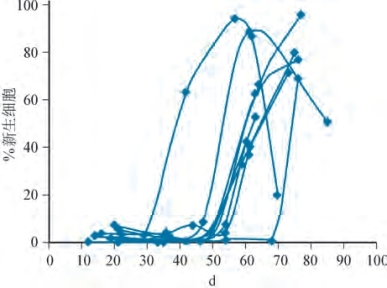
图2-13 精子生成至射出所需的时间。精母细胞标记整合曲线:11个正常精液质量的男性每天两次摄入50ml的2 H2 O 共3周。摄入标记物后最早42d在射出精子中发现新的未标记的精子,生成和射出精子所需时间存在相当大的个体差异(From Misell LM,Holochwost D,Boban D,et al.A stable isotope/mass spectrometric method for measuring the kinetics of human spermatogenesis in vivo.J Urol 2006;175:242-6.)
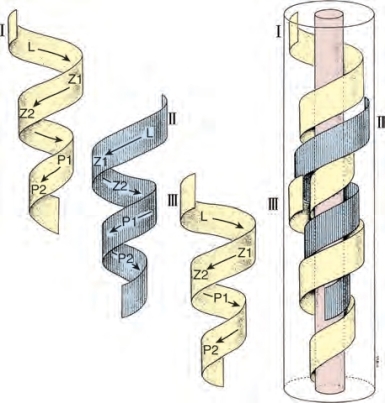
图2-14 人类生精小管中生精周期的螺旋形构造,形成精子发生重叠波,保持精子生成恒定(From Schulze W,Rehder U.Organization and morphogenesis of the human seminiferous epithelium.Cell Tissue Res 1984;237:395-407.)
精子发生周期涉及从原始精原干细胞分裂为后续的生殖细胞。生精上皮上可同时观察到数个生精周期,并且在形态学上被区分为各个阶段。
1.睾丸干细胞迁移、更新和增殖
(1)睾丸干细胞迁移:在胎儿早期发育期间,原始生殖细胞迁移至性腺嵴联同支持细胞形成原始睾丸索(Witschi,1948)。原始生殖干细胞在生殖腺通过形成生精小管索分化成睾丸后,被称为生殖母细胞(gonocytes)。原始生殖干细胞迁移至生殖腺,被称为精原细胞(spermatogonia)(Gondos and Hobel,1971)。有趣的是,这些早期迁移的生殖细胞具有与胚胎干细胞非常相似的特性,并且可能是成人生殖细胞肿瘤的来源(Ezeh et al,2005)。
(2)睾丸干细胞自我更新:位于干细胞龛或微环境的精原细胞在被称为干细胞更新的过程中得到补充。生长因子受体kit配体/c-kit受体系统和干细胞龛因子——胶质细胞源性神经营养因子(GDNF)似乎参与了这一过程(Oatley and Brinster,2008)。事实上,c-kit受体是大鼠精原干细胞的标志物(Dym,1994),大鼠精子生成是ckit依赖性过程,而精原干细胞更新可能是独立于c-kit的进程(Yoshinaga,1991)。最近的研究还表明,人类精原干细胞可在体外重新组成胚胎样干细胞(Conrad et al,2008;Kossack et al,2009)(图2-15)。从成人睾丸活检获得的标本中,胚胎样细胞表现出多潜能的特殊标记(OCT-4、SOX-2、STELLAR、GDF-3),可形成所有三个胚层、维持正常核型、形成畸胎瘤、表达适当水平的表观遗传标记和端粒酶(Kossack et al,2009)。这一发现表明,对于未来基于细胞治疗的患者,睾丸可能是特异性干细胞的来源。
(3)睾丸干细胞增殖:在人类中,生精小管的基底干细胞龛或微环境中的亮A型精原细胞(Ap)以16d的间隔分裂(Clermont,1972),形成B型精原细胞。B型精原细胞将成为精母细胞,但精原细胞子细胞之间的细胞质在有丝分裂后仍保持联合,在相邻细胞之间形成胞质桥。在整个精子发生过程中,所有类型的生殖细胞都能观察到这些胞质桥(Ewing et al,1980)。这些胞质桥可能对于细胞增殖同步、分化及基因表达的调节至关重要。
2.减数分裂
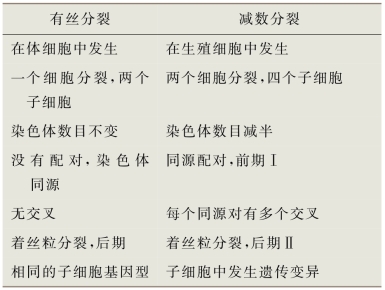
体细胞通过有丝分裂进行复制,形成基因相同的子细胞。生殖细胞通过减数分裂进行复制,遗传物质减半形成繁殖。减数分裂形成了遗传多样性,提供了更丰富的遗传物质来源,使自然选择发挥作用。通过有丝分裂进行的细胞复制很精确,该过程涉及遗传物质(染色体)复制、核膜破裂,以及染色体和胞质平均分配至子细胞等序列事件。有丝分裂和减数分裂复制的本质区别在于,有丝分裂中单个DNA复制之后只有一次细胞分裂,但在减数分裂中有两次细胞分裂(四次子细胞)。因此,子细胞只含有亲本细胞染色体含量的一半。因此,二倍体(2n)亲本细胞变成单倍体(n)配子。表2-2列出了有丝分裂和减数分裂之间的其他主要差异。研究表明,包括小干扰RNA(siRNA)、微小RNA(miRNA),以及与piwi相互作用的RNA(piRNA)在内的小RNA分子(small RNAs)是转录后或翻译水平上生殖细胞基因表达的重要调节因子(Tolia and Joshua-Tor,2007;He et al,2009)。
表2-2 有丝分裂和减数分裂的重要差异
精子发生始于生精小管腔内的B型精原细胞有丝分裂形成初级精母细胞。成熟的精母细胞是进行减数分裂的第一批生殖细胞(Kerr and de Kretser,1981)。在这个过程中,将进行两次减数分裂,产生具有互补的单倍染色体子细胞。另外,由于染色体重组,每个子细胞都含有不同的遗传信息。由此产生的细胞是Sa型精子细胞(见图2-11)。
染色体重组是哺乳动物减数分裂的主要特征,可确保单倍体配子在遗传上与其成熟前体细胞不同,并且是遗传多样性和进化的真正动力。在减数分裂前期,同源(母本和父本)染色体配对形成联合复合体,与同源染色体之间进行物理相互作用和DNA相应位点的交叉交换。近期研究表明,男性生殖细胞内重组的保真性缺陷会导致无精子症和男性不育(Walsh et al,2009)。在一项研究中,与正常男性精子发生相比,10%的非梗阻性无精子症患者在重组方面存在显著缺陷(Gonsalves et al,2004)。另外,在睾丸活检中发现,成熟阻滞的男性中,约有一半的病例发生错误重组,这提供了重组错误与生精障碍相关的证据(Gonsalves et al,2004)。重组变异可影响精子非整倍体,因为交叉位置的改变是染色体不分离的危险因素。事实上,有证据表明无精子症患者中错误重组与精子非整倍体的相关性,足以解释体外受精(lVF)和卵胞浆内单精子注射(lCSl)后代中染色体异常率较高的情况(Sun et al,2008)。
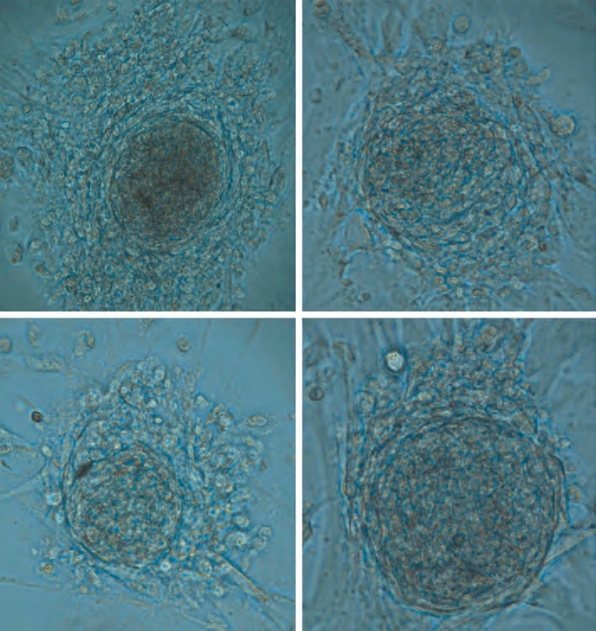
图2-15 来自成人睾丸精原干细胞的四种不同集落的显微图片。细胞簇是成人精原细胞重编程的结果[在人类胚胎干细胞(HESC)的培养条件下]。HESC呈现典型鹅卵石外观并且是多潜能的
3.精子形成
在精子形成过程中,圆形Sa型精子细胞成熟成为精子(见图2-11)。在此成熟过程中,不发生细胞分裂,但精子细胞核和细胞质发生广泛变化。
包括细胞质的丢失、胞质细胞器的迁移、高尔基体形成顶体、中心体形成、核固缩至原大小的10%,以及围绕精子中段的线粒体重组(Kerr and de Kretser,1981)。随着染色质浓缩,圆形精子细胞核从球形变为不对称。许多细胞成分参与该重塑过程,包括染色体结构、相关染色体蛋白质、核周细胞骨架膜蛋白层、核微管流苏结构、顶体下的肌动蛋白,以及与支持细胞相互作用。随着精子细胞延伸的完成,支持细胞胞质在发育精子的周围回缩,除去所有不必要的胞质成分,并将其挤出至管腔中。成熟的精子胞质极少,精子的产生量很大,每克睾丸每秒高达300个。
4.支持细胞-生殖细胞相互作用
睾丸内存在着复杂的细胞间相互作用网络,间质细胞和支持细胞之间、间质细胞和管周细胞之间、支持细胞和管周细胞之间、支持细胞和生殖细胞之间。哺乳动物睾丸中几种关于支持细胞-生殖细胞的关联如图2-10所示(Russell and Clermont,1976;Romrell and Ross,1979;Skinner,1995)。此外,还有一些因素能够可逆地破坏血-睾屏障,包括TGF-β3和肿瘤坏死因子-α(TNF-α)。这些物质通过p38丝裂原活化蛋白(MAP)激酶信号通路降低屏障中闭合蛋白(occludin)和紧密连接蛋白-1(ZO-1)的水平(Xia et al,2009)。这仅代表了精子发生过程中非常复杂和高度互动的部分内容。
5.遗传学
精子发生异常的遗传因素逐渐被阐明。如单个基因(例如囊性纤维化)点突变,与染色体片段(或全部)结构或数量异常,遵循孟德尔方式遗传导致不育。读者可以参考Turek和Reijo Pera(2002)对这些疾病的综述。Y染色体长臂缺失导致无精子症的假说已超过30年(Tiepolo et al,1976)。基于细胞遗传学分析,该区域理论上被称为无精子症因子(AZF)。目前,AZF区域的位点缺失模式(称为微缺失)用于将该区域细分为AZFa、AZFb和AZFc亚区域(Vogt et al,1996)。Y染色体区域缺失称为Yq微缺失,可在6%~8%的严重少精子症和15%的无精子症患者中发生(Reijo et al,1996)。总之,这种缺失是男性不育症最常见的分子病因(Kostiner et al,1998)。
不断有文献阐述AZF缺失类型,对精子发生障碍的预后价值。对于部分和完全AZFc缺失患者,在精液分析或睾丸活检中经常发现精子,而在完全AZFa或AZFb缺失男性的精液或睾丸中,发现精子的概率几乎为0(Hopps et al,2003)。完全AZFa缺失与生殖细胞发育不全或唯支持细胞综合征相关。一般而言,完全AZFb缺失与初级精母细胞(早期)或精子细胞(晚期)精子发生成熟停滞相关。AZFc缺失与生精功能低下或唯支持细胞综合征伴局灶性生精相关。但曾经有报道,部分AZFa和AZFb缺失的男性精液中曾经检测到精子(Foresta et al,2001)。同样,也有报道在AZFa+b和AZFb+c缺失(可能是部分缺失)的男性精液中发现精子,但AZFa-c的缺失与无精子症相关,睾丸活检无法找到精子。
近期在啮齿动物研究中率先报道X染色体对精子发生也很重要。2001年Wang和同事系统检索了小鼠精原细胞中特异表达的基因(Wang et al,2001)。通过互补DNA(c DNA)消减鉴定了25个基因,其中10个定位于X染色体,这表明X染色体可能在生精的减数分裂前期具有关键作用。最近对小鼠和人类X染色体的比较表明,X染色体可能对男性和女性的生育力同样重要(Mueller et al,2013)。男性不育患者X连锁基因突变的研究已经将SOX3基因(性别决定区域Y框3)和FATE基因鉴定为两个潜在的候选生育基因(Olesen et al,2003;Raverot et al,2004)。未来,这些X染色体上的基因突变有可能用来定义许多目前不明原因的男性不育症病例。
6.遗传和父亲年龄
(1)年龄相关的精子染色体异常:由于男方高龄与后代三体特别是21-三体(唐氏综合征)的增加相关,因此首先研究了精子的非整倍体和多倍体状态。利用荧光原位杂交(FISH)技术,目前已经证实,父亲年龄对精子非整倍体的影响。父亲年龄增长似乎增加了性染色体非整倍体精子的比例(Wyrobek et al,1996)。然而,几乎没有证据支持父亲年龄增长与非整倍体新生儿的增加有关,除了21-三体和1-双体综合征(非常罕见)。Martin和Rademaker(1987)研究了精子染色体结构异常,发现父亲年龄与精子结构异常发生率存在显著线性关系(r=0.63)。这种关联的一种可能解释是,在精子发生过程中持续的细胞分裂使生殖细胞处于染色体损伤的风险,尤其当父亲年龄较大时。然而,除了交互易位之外,几乎没有证据表明这种关联导致子代发生染色体结构异常的频率增加。
(2)年龄相关的精子基因突变:精子中的单基因缺陷是由DNA复制错误造成。迄今为止,很难评估精子中是否存在这种缺陷。但是男方年龄对后代单基因缺失的影响是明确的。在框图2-1中,列出了一些常染色体显性遗传疾病,这些疾病已知与父亲高龄有关。由于具有明显的频率异常和低适应性,且源自高度显性突变,被称为早期特征性表型。随着年龄增长新出现的单基因突变机制涉及生精过程中精原细胞分裂的特征和连续过程。到青春期为止,精原细胞已经发生了30次细胞分裂,生成大量的未分化细胞。青春期过后,这些细胞每年发生23次分裂。事实上,老年男子的精原细胞经历了无数次细胞分裂,使它们更可能在DNA转录中出现错误,这是单基因缺陷的来源。男方高龄造成常染色体显性突变的风险评估结果:对于年龄小于29岁的男性,后代发生突变的风险为0.22(每1000名新生儿);年龄为40-44岁的父亲,这种风险加倍(0.45/1000);在年龄大于45岁时风险上升至3.7(每1000名新生儿)(Friedman,1981)。
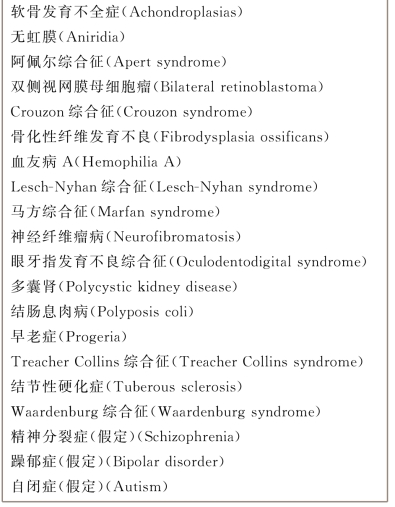
框图2-1 与男方高龄相关的遗传疾病
要点:睾丸
•年轻成人的睾丸生精小管长约250m,含7亿个支持细胞。
•精子发生分为多个阶段、周期和波,确保精子的持续产生。
•X及Y染色体上的基因控制着精子发生,其异常可导致男性不育。
•随着父亲年龄的增长,精子染色体结构异常增多,常染色体显性突变导致后代早期特征性表型发生率前哨表型增加。
