阴茎勃起的神经解剖学与神经生理学
1.脊髓中枢与外周通路
阴茎的神经支配包括自主神经(交感神经和副交感神经)和躯体神经(感觉和运动)(图6-7)。交感神经和副交感神经在脊髓和周围神经节的神经元合并形成海绵体神经,进入阴茎海绵体和尿道海绵体,调节勃起和消退时的神经血管变化。躯体神经主要负责球海绵状肌和坐骨海绵体肌的感觉和收缩。
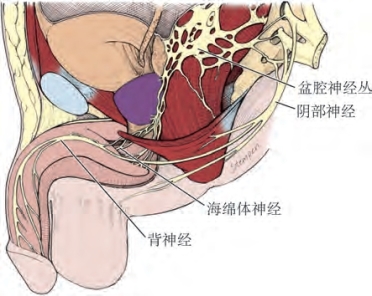
图6-7 阴茎神经解剖
(1)自主神经途径:交感神经通路起源于第11胸髓至第2腰髓节段,并通过白色交通支进入交感神经神经节。一些纤维通过腰内脏神经传导到肠系膜下神经丛和肠系膜上神经丛,从下腹部神经传导到盆腔神经丛。在人类中,交感神经纤维常起自第10胸髓和第12髓椎,投射到阴茎的神经节细胞位于骶神经节和尾神经节(de Groat and Booth,1993)。
副交感神经通路起源于第2、第3和第4骶髓节段中间外侧细胞柱中的神经元,节前神经进入盆腔神经丛,由上腹下丛交感神经连接。海绵体神经是盆腔神经丛的分支,支配阴茎。其他的分支支配直肠、膀胱、前列腺和括约肌。在直肠、膀胱和前列腺的根治性切除术中,海绵体神经很容易受损。清楚地了解这些神经的走行,对于预防医源性勃起功能障碍是必不可少的(Walsh et al,1990)。人体尸体解剖发现海绵体神经有内侧和外侧分支(前者伴随尿道,后者穿过泌尿生殖隔膜,距括约肌4~7mm),并且海绵体神经和背神经之间有很多联系(Paick et al,1993)(图6-8)。盆腔神经节细胞除了存在于海绵体神经本身外,还存在于沿着神经分布的盆腔脏器。这些在膀胱/前列腺连接处、精囊的背侧,以及前列腺周围均可见到。Takenaka及其同事(2005)报道了雄性骨盆壁外神经节细胞分布的个体差异,这可能会使保留神经的手术变得复杂化。
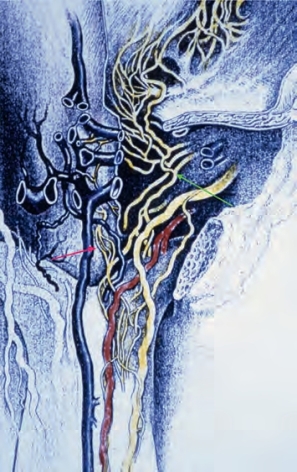
图6-8 人体尸体解剖显示前列腺远端海绵体神经的中间束(红色箭头)和外侧束(绿色箭头)(From Paick JS,Donatucci EF,Lue TF.Anatomy of cavernous nerves distal to prostate:microdissection study in adult male cadavers.Urology 1993;42:145-9,with permission from Excerpta Medica,lnc.)
盆腔神经丛和海绵体神经的兴奋导致阴茎勃起,而交感神经干的兴奋导致勃起消退。这显然意味着骶副交感神经的信号通路介导勃起,胸腰交感神经信号通路介导消退。在猫和大鼠的实验中,切除L4或L5以下的脊髓会导致勃起反应消失,但是通过异性刺激内侧视前区会产生明显的勃起反应(Giuliano et al,1996;Sato and Christ,2000)。Paick和Lee还报道,阿扑吗啡诱导勃起与大鼠心理性勃起相似,并且在骶副交感中枢损伤时可通过胸腰髓交感神经通路诱导勃起。许多患有骶髓损伤的男性保留了心理性勃起能力,尽管这些患者的反射性勃起功能已经被废除。这些大脑诱发的勃起在T 12以下运动神经元病变患者中更常见(Courtois et al,1999),T 9以上损伤的患者不会出现心理性勃起。交感神经信号传出应在T 11和T 12水平(Chapelle et al,1980)。该研究还发现,心理性勃起功能障碍的患者,会有阴茎的增大和增粗,但是阴茎硬度达不到要求。
正常人在强直期时,大脑神经冲动经过以下几种方式传导:通过抑制交感神经通路和减少去甲肾上腺素释放;通过副交感神经途径释放NO和乙酰胆碱;通过躯体途径释放乙酰胆碱。在有骶髓损伤的患者中,大脑神经冲动仍然可以通过交感神经途径抑制去甲肾上腺素的释放,NO和乙酰胆碱仍可通过神经节后副交感神经元和躯体神经元的突触释放。因为这些突触的数目比有完整骶髓的人的突触数目少,由此产生的阴茎勃起就不会那么坚硬。
(2)躯体途径:躯体感通路起源于阴茎皮肤、阴茎头、尿道和阴茎海绵体内的感受器。人阴茎头中有许多传入神经末梢:游离神经末梢和海绵体受体的比例为10∶1。游离神经末梢来源于有髓的Aδ纤维和无髓C纤维,与身体内其他任何区域不同(Halata and Munger,1986)。受体的神经纤维汇合形成阴茎的背侧束,最后汇合其他神经成为阴部神经。后者通过S2-S4脊髓根进入脊髓,终止于腰骶段中央灰质区的脊髓神经元和中间神经元(Mc Kenna,1998)。这些感觉神经元的激活通过脊髓丘脑和感觉神经皮质来传递疼痛、温度和触觉的信息。
Kozacioglu等(2014)报道了关于背侧神经的详细研究。他们发现,阴茎的背神经由2到6支组成,在22具成人尸体标本中,16具尸体的背神分支经白膜进入海绵体。阴茎的背神经以前被认为是纯粹的躯体性神经;然而,Burnett团队(1993)对人的背神经研究以及Carrier团队(1995)对大鼠背神经研究证实,NOS阳性神经束起源于自主神经。大鼠前列腺附近海绵体神经损伤后,背神经NOS阳性神经束减少。Giuliano团队(1993)研究表明,刺激L4-L5水平的交感神经可引起大鼠阴茎背神经的放电,刺激背神经可引起腰骶交感神经的再放电。这些实验表明,背神经具有躯体和自主神经成分,使其能够调节勃起和射精功能。第2到第4骶段的Onuf核是支配阴茎躯体运动神经的中枢,这些神经从骶神经延续到阴部神经,支配坐骨神经和球海绵体肌。坐骨神经肌肉的收缩会导致阴茎勃起。在外括约肌松弛及海绵体肌压迫尿道海绵体的前提下,海绵体近端的球海绵体肌有节奏地收缩有助于精液的排出。在动物研究中,脑干交感神经中枢(α5-儿茶酚胺能细胞群和蓝斑)直接支配骶髓运动神经元。在射精过程中,肾上腺素能神经支配的阴部运动神经元可能参与会阴肌的节律性收缩。此外,该研究还证实了腰骶核的氧化反应和血清素激活控制雄性大鼠阴茎勃起和会阴肌(Tang et al,1998)。
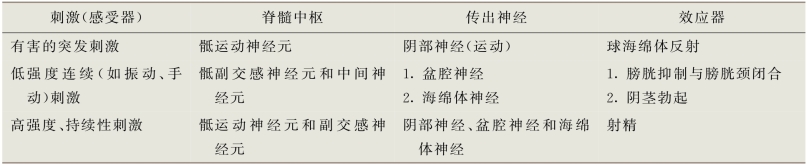
根据生殖刺激的强度和性质的不同,可以诱发下列几种脊髓反射(表6-4)。最著名的是球海绵体反射,该反射是生殖神经学检查和电生理潜伏期测试的基础。由于球海绵体和坐骨肌的损伤可能会影响勃起,因此利用球海绵体反射对性功能全面评估是有争议的。
表6-4 刺激阴茎背神经兴奋的脊髓反射
2.脊髓上高级中枢信号通路
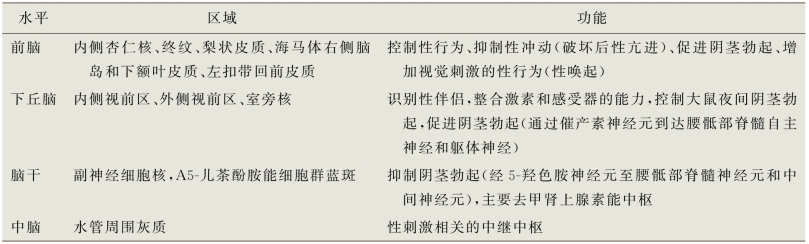
高级中枢对传入信息的整合和加工(如视觉、嗅觉、想象、生殖刺激)对于阴茎勃起的启动和维持必不可少。Hubscher和Associates(2010)在T 8水平进行的一项脊柱横断研究表明,脊髓背侧、背外侧和腹外侧白质向双侧延髓网状结构投射传递了从男性外生殖器到延髓网状结构的信息。他们认为,这些脊髓通路可能对应于不同的功能,包括情感、快感和动机的处理功能;痛觉以及特定于交配(勃起和射精)的信息传递。在动物研究中,控制性觉醒的中央系统主要位于边缘系统(如嗅核、MPOA、伏隔核、杏仁核和海马)和下丘脑(室旁核和腹内侧核),其中杏仁内侧核、MPOA、室旁核(PVN)、导水管周围灰质和腹侧被盖被认为是控制男性性反应中枢的关键结构(Andersson,2011;Melis and Argiolas,2011)。
正电子发射断层扫描(PET)和功能性磁共振成像(f MRI)通过显示脑血流的增加或特定时刻脑活动的变化,使人们能够更好地理解人类性觉醒过程中的脑活动。一般来说,在年轻的异性恋男性中,性唤起是由性感的图片或视频引起的。将性唤起期间拍摄的脑扫描图像,与针对非色情图片或视频(如纪录片或幽默视频剪辑)拍摄的脑扫描图像进行比较,可以证明大脑激活和失活的中枢部位。尽管这些研究设计简单明了,但性唤起涉及多种因素,尤其是视觉信息。这些研究人员在实验中创造了许多必要的条件,试图对方法和参与者进行标准化。然而,人类情绪和性反应的复杂性是极其难以调节的(表6-5)。
Kühn和Gallinat(2011)对11项f MRI研究进行了定量Meta分析,比较了色情视觉刺激和非色情视觉刺激对大脑活动的影响。Meta分析确定了一个神经网络,它构成了男性性唤起的核心结构,由认知(顶叶皮质、扣带回前回、丘脑、岛叶)、情感(杏仁核、岛叶)、动机(中央前回、顶叶皮质)和生理(下丘脑/丘脑、脑岛)等部分组成。
使用f MRI,研究者详细比较不同的组中给予视觉性刺激后大脑活动的情况。Stoléru和他的同事(2003)对患有性欲减退症的男性进行了研究后发现,左侧直回和眶额部皮质内侧部处于激活状态,而健康男子则处于不活跃状态。这一区域被认为可以抑制性欲的唤起,并且其持续激活可以帮助解释低活跃的性欲障碍的病理生理学。Montorsi和他的同事(2003)比较了服用阿扑吗啡后患有心理性ED的男性和能控制勃起的受试者男性后发现,在视觉性刺激中,患有心理性ED的男性表现为扣带回、额中叶和额叶基底皮质的兴奋时间延长,提示这可能是导致心理性ED的一个潜在病因。然而,这两组男性的f MRI结果相似。阿扑吗啡可引起心理性ED患者(伏隔核、下丘脑和中脑)的额外兴奋,右半球比左侧更明显。这种右侧半球显著的兴奋现象,在性诱发脑兴奋研究中是很常见的。
表6-5 与性功能有关的大脑中枢
用PET和f MRI进行脑扫描已成为研究性唤起时大脑功能强有力的工具,在这些研究中发现了许多激活的大脑区域(表6-6)。心理性ED、早泄、性偏差和性高潮障碍只是伴随着大脑功能改变的几种情况,也许现在有学者已经研究清楚。当我们了解了大脑在正常的性反应和觉醒中如何发挥功能后,或许就能了解导致勃起功能障碍的原因。
表6-6 视觉性刺激时的脑激活区*
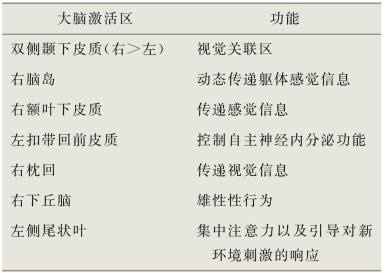
*在多项研究中,进行视觉性刺激后,这些区域相应地被激活
前面讨论的内容是导致三种类型勃起的原因:心理性、反射性和夜间性。心理性勃起是视听刺激或幻想的结果,大脑的冲动调节脊髓的勃起中枢(T 11-L2和S2-S4)以激活勃起过程。反射性勃起是通过触觉刺激生殖器官产生的。产生的冲动到达脊髓勃起中枢,一些信号随后向上传导到大脑,产生感觉知觉;而另一些信号则激活自主神经,通过海绵体神经向阴茎发送信息,以诱导勃起。脊髓上段损伤的患者仍可以保留此种类型的勃起。夜间勃起主要发生在快速动眼(REM)睡眠时期。在REM睡眠时期,PET扫描显示脑桥区、杏仁核和扣带回活动增加,而前额叶和顶叶皮质活性下降。触发REM睡眠的机制位于脑桥网状结构,脑桥被盖外侧的胆碱能神经元被激活,而蓝斑的肾上腺素能神经元和中脑中缝的5-羟色胺能神经元保持非激活状态。在一项对大鼠脑部刺激的研究中,REM睡眠中诱发勃起的部位位于侧间隔的背侧和中间部,而清醒时诱发勃起最有效的部位位于侧间隔腹部(Gulia et al,2008)。
研究者也研究了性高潮和射精期间大脑兴奋区域。Holstege和他的同事(2003)用PET测量发现异性恋志愿者射精和性刺激时局部脑血流量有所增加。当志愿者的女性伴侣对志愿者进行人工阴茎刺激时,原发性脑活动则发生在中脑过渡区(包括腹侧被盖区)。这一区域和奖励行为以及注射阿片类如海洛因成瘾相关。其他激活的中脑结构包括中脑外侧中央被盖野、透明带、束旁核,以及腹后核、中线核和丘脑内核;侧壁壳核及相邻部分的激活也明显增强。在Brodmann 7/40、18、21、23和47区均有新皮质兴奋,仅位于右侧。相反,在杏仁核和邻近的内嗅皮质,则观察到了兴奋减少,小脑血流量明显增加。这些事实证实了小脑在情绪传递中起着重要作用的观点。虽然这些特定区域的兴奋是很有意义的,但要完全了解性高潮、射精和性满足的神经生物学,还需要进一步的研究(表6-7)。
表6-7 性高潮相关脑中枢

3.神经递质
(1)周围神经递质与内皮源性因子
①阴茎疲软和消退:α-肾上腺素能神经纤维和受体存在于海绵体小梁及海绵体动脉周围,去甲肾上腺素是维持阴茎处于疲软状态的主要神经递质(Andersson,2011;Diederichs et al,1990)。人阴茎海绵体组织中同时具有α1-肾上腺素能受体和α2-肾上腺素能受体。研究表明,α1-肾上腺素能受体主要起收缩作用,而α2-肾上腺素能受体主要负责下调去甲肾上腺素和NO释放(Prieto,2008)。去甲肾上腺素从肾上腺素能神经释放,刺激阴茎血管和海绵体中的肾上腺素能受体,通过钙通道产生由蛋白激酶C、酪氨酸激酶和rho激酶介导的依赖钙离子的收缩(Andersson,2011)。
内皮素-1由内皮细胞合成,是一种比肾上腺素更强的血管收缩药,在阴茎勃起后消退中起作用。内皮素-1可以诱导阴茎的不同平滑肌组织:阴茎海绵体、海绵体动脉、背深静脉和阴茎外静脉长时间缓慢收缩。内皮素还能增强儿茶酚胺对小梁平滑肌的收缩作用(Christ et al,1995b)。内皮素的两种受体内皮素-A和内皮素-B,介导内皮素在血管组织中的生物学作用:内皮素-A受体介导收缩作用,而内皮素-B受体介导舒张作用。
前列腺素包括前列腺素I2(PGI2)、前列腺素F2α(PGF2α)和血栓素A 2(TXA 2),它们由人体海绵体组织分泌。体外研究表明,前列腺素对离体海绵体小梁的张力和活性起着重要作用。对海绵体小梁和阴茎动脉平滑肌中前列腺素受体的功能研究表明,前列腺素对这些组织的收缩作用仅通过血栓素A 2(TP)受体介导。同时,体外研究显示,与NO同时释放的前列腺素减弱了NO对血管的扩张作用(Minhas et al,2001)。
肾素-血管紧张素系统(RAS)在维持阴茎平滑肌张力中也具有重要作用。RAS系统包括两条主要途径:一种是血管收缩/增殖途径,主要通过递质血管紧张素Ⅱ作用于血管紧张素(AT 1)受体完成;另一种是血管扩张/抗增殖途径,主要由血管紧张素(1-7)通过G蛋白偶联受体Mas发挥作用(Christ et al,1995b)。这两条途径中递质和受体间的作用已在阴茎海绵体中得到证实。RAS系统也可能在阴茎勃起功能中具有双重作用:一是血管紧张素Ⅱ-AT1轴介导的促消退功能,二是血管紧张素(1-7)-Mas轴介导的促勃起功能。Uckert和他的同事(2012)也报道了在勃起时海绵体血神经肽Y的水平下降,提示神经肽Y可能参与了阴茎疲软的维持。此外,内皮细胞还能释放出强效的血管收缩因子,包括内过氧化物、TXA 2和超氧阴离子。
目前的共识认为,海绵体平滑肌半收缩状态的维持可能与三个因素相关:内源性肌活动(Andersson and Wagner,1995);肾上腺素能神经传递以及血管紧张素Ⅱ、PGF2α、内皮素-1等内皮源性收缩因子的作用;勃起后消退可能是由于NO停止释放、环磷酸鸟苷(cGMP)被PDEs降解和射精时交感神经兴奋所致。
②勃起:乙酰胆碱已被证明是通过电信号刺激海绵体组织释放的,Traish及其同事(1990)研究发现,海绵体组织中毒蕈碱受体的密度为35~65fmol/mg蛋白,内皮细胞膜中的M受体密度为5~10fmol/mg蛋白。然而,静脉注射或海绵体注射阿托品不能消除电刺激引起的动物勃起(Stief et al,1989a)和性刺激引起的男性勃起(Wagner and Uhrenholdt,1980)。虽然乙酰胆碱不是主要的神经递质,但它能够通过突触前抑制肾上腺素能神经元以及刺激内皮细胞释放NO来间接促进阴茎勃起(Tejada et al,1989a)。
目前,大多数研究人员一致认为,非肾上腺素能/非胆碱能神经递质释放的NO和内皮释放的NO是介导阴茎勃起的主要神经递质。NO增加cGMP的产生,使海绵体平滑肌松弛(Ignarro et al,1990;Kim et al,1991;Burnett et al,1992;Rajfer et al,1992;Trigo-Rocha et al,1993;Andersson,2011)。大家一致认为,神经元型一氧化氮合酶(n NOS)介导产生的NO参与了阴茎勃起的起始阶段,内皮型一氧化氮合酶(eNOS)介导产生的NO参与了平滑肌的松弛和勃起的持续维持(有关NO的更详细讨论,请参见特定的NO部分)。
内皮除了能释放血管收缩因子外,还能释放导致平滑肌松弛的因子,包括一氧化碳(CO)、内皮衍生超极化因子(EDHF)、前列环素(PGI2)和内皮素(ET)(Hurt et al,2002)(可能通过激活内皮素-B受体而引起舒张)。
(2)神经和神经递质之间的相互作用:乙酰胆碱通过作用于肾上腺素能神经元的突触前受体,调节去甲肾上腺素的释放(Saenzde Tejada et al,1989b),PGE1也可以抑制去甲肾上腺素的释放。在人阴茎海绵体中,去甲肾上腺素能的释放受NO影响(Molderings et al,1992)。相反,肾上腺素能神经元通过α2受体也能调节NO的释放。
一些研究表明,平滑肌中也存在这两个系统之间的相互作用。NO-cGMP-蛋白激酶G(PKG)-I通路可抑制血管平滑肌中去甲肾上腺素能收缩通路的多个位点,降低磷脂酶C(Hirata et al,1990)、IP3受体活性(Schlossmann et al,2000)和Rho A/Rho激酶途径产生的肌醇1,4-磷酸三磷酸(IP3)水平(Sauzeau et al,2000)。然而,阴茎平滑肌中的相互作用位点尚未确定。神经传导缺陷引起的NO-去甲肾上腺素失衡和动物模型与患者ED的发生有密切联系(Christ et al,1995a;Cellek et al,1999)。NO和去甲肾上腺素通路的相互作用相似,内皮素的血管收缩作用在勃起过程中受到NO的抑制(Mills et al,2001)。
有许多因素可以提高一氧化氮合酶的活性和NO的释放,包括氧分子、雄激素、长期使用L-精氨酸和反复注射PGE1(Kim et al,1993;Escrig et al,1999;Marin et al,1999)。一氧化氮合酶(NOS)活性降低与去势、去神经支配、高胆固醇血症和糖尿病有关。不同类型NOS之间也会相互作用。例如,向阴茎内注射转化生长因子-β1后,n NOS活性下降,诱导型一氧化氮合酶(INOS)水平升高(Bivalacqua et al,2000),并且有研究证明n NOS基因敲除的小鼠的eNOS水平显著升高(Burnett et al,1996)。
在对人海绵体和海绵体神经递质的研究中,Hedlund等(2000b)研究发现,囊泡型乙酰胆碱转运体、血管活性肠肽(VIP)和n NOS存在于同一神经末梢。含有酪氨酸羟化酶的神经不释放囊泡型乙酰胆碱转运体、VIP或NOS。血红素加氧酶(HO)包括HO-1、HO-2以及eNOS均位于内皮细胞内,这些神经递质的相互作用可能改变副交感神经和交感神经激活对阴茎功能的影响。
(3)微囊的作用:微囊是质膜的穴样内陷区域,富含eNOS和Caeolins,以及胆固醇、鞘脂和糖基磷脂酰肌醇连接蛋白。此外,微囊还含有许多其他信号蛋白,如具有七个跨膜结构域的受体、G蛋白、腺苷酸环化酶、磷脂酶C、蛋白激酶C、钙泵和钙通道。有研究发现,老年大鼠海绵体平滑肌中微囊-1表达降低(Bakircioglu et al,2001)。Linder团队(2006)研究证明,阴茎勃起的条件之一是可溶性鸟苷酰环化酶与大鼠阴茎海绵体内皮细胞微囊蛋白-1的结合。Shakirova团队(2009)发现,在微囊蛋白-1缺陷的小鼠中,其神经介导的阴茎组织的舒张功能是受损的。双侧海绵体神经损伤后,海绵体平滑肌和内皮细胞的微囊蛋白-1均减少(Becher et al,2009)。在果糖和链脲佐菌素诱导的糖尿病大鼠模型中,Elioglu团队(2010)发现,两组糖尿病大鼠的勃起功能下降,微囊蛋白-1表达增强,eNOS活性降低导致NO合成减少。这些研究有力地说明了微囊和微囊蛋白参与了阴茎功能的调节。
(4)中枢神经递质和神经肽:许多神经递质和神经肽参与调节性功能。主要有多巴胺、催产素、NO、去甲肾上腺素、5-羟色胺(5-HT)和催乳素等。一般而言,多巴胺能和肾上腺素能受体促进性功能,而5-羟色胺受体则抑制性功能(Foreman and Wemicke,1990)。雄激素在调节这些神经递质的作用方面也起着重要作用。
①多巴胺:大脑中有许多多巴胺系统,包括超短、中间和长轴突。细胞体位于腹侧被盖、黑质和下丘脑。多巴胺能系统中的结节漏斗系统,可以分泌多巴胺进入门脉垂体血管,以抑制催乳素的分泌(Ganong,1999a)。目前,研究人员已经克隆了5种不同的多巴胺受体(D1~D5),其中几种受体是以多种形式存在的(Ganong,1999b)。在男性中,阿扑吗啡刺激D1和D2受体引起勃起,但不伴有性唤醒。神经学家发现,多巴胺受体(D2、D3和D4)、n NOS和催产素在PVN和MPOA的催产素能神经元胞体中共同表达(Xiao et al,2005;Baskerville et al,2009)。雄性大鼠中,在PVN注射多巴胺能激动剂刺激D2受体,而不刺激D3或D4受体,能够增加催产素能神经元胞体Ca2+内流。这增加了NO的产生,从而激活下丘脑外脑区和脊髓的催产素能神经传递,导致阴茎勃起和打哈欠。D4受体的刺激也增加了Ca2+内流和NO生成,导致阴茎勃起,但不包括打哈欠。尽管如此,D4受体在促进勃起作用中似乎只起着一定的作用(Melis and Argiolas,2011)。
在许多国家,有以舌下含化多巴胺激动剂,如阿扑吗啡用于治疗ED,但由于其呕吐的不良反应,应用受到限制。
②催产素:催产素是由神经元分泌进入循环系统的神经激素。它在垂体后叶中被发现,但因为它也存在于从下丘脑室旁核到脑干和脊髓的神经元轴中,因此它也可以起到神经递质的作用。在人类和动物的性活动期间,催产素的血液含量增加。将催产素注射到中枢神经系统(CNS)时,它能有效地诱导阴茎勃起(Succu et al,2007)。如前所述,室旁区的神经元含有一氧化氮合酶,而且由于一氧化氮合酶抑制剂可抑制阿扑吗啡和催产素所致的勃起,因此催产素促进勃起依赖于一定量的NO(Vincent and Kimura,1992;Melis and Argiolas,2011)。
③一氧化氮(NO):NO通过PVN通路和促进性唤醒的其他神经通路介导阴茎勃起(Melis et al,1998)。在人类整个大脑中都能看到NO和可溶性鸟苷酸环化酶(cGMP)的存在。NO/c GMP通路(见后文)受脑老化的影响,为年龄对性功能的影响提供了一个潜在的理论支持,但尚未深入研究(Ibarra et al,2001)。在链脲佐菌素诱导的糖尿病大鼠中,PVN神经通路内n NOS的减少导致勃起反应减弱(Zheng et al,2007)。在动物体内,睾酮增加MPOA中的NOS。NO增加基础多巴胺和女性刺激后多巴胺释放,促进交配和生殖。在啮齿类动物中,去势多巴胺受体激动剂引起的勃起被去势所消除,睾酮替代治疗后恢复勃起功能(Hull et al,1999)。
④5-HT:含有5-HT的神经元的胞体在脑干中缝核群内,并投射到下丘脑、边缘系统、新皮质,以及一部分脊髓(Ganong,1999a)。目前,已克隆并鉴定了1~7组的5-HT受体。5-HT 1受体中有A、B、D、E和F亚型;5-HT2受体中有A、B、C亚型;5-HT 5受体中有A、B亚型(Ganong,1999b)。一般药理学资料表明,5-HT途径可抑制交配,但5-HT可能同时对性功能有促进和抑制作用,这取决于受体的亚型、位置和种类(de Groat and Booth,1993)。Andersson和Wagner(1995)综述了选择性激动剂和拮抗剂的给药结果:5-HT1A受体激动剂抑制勃起活动,但有助于射精,刺激5-HT2C受体促进勃起,5-HT2激动剂抑制勃起但有助于射精。另外Steers和de Groat(1989)研究发现,给大鼠注射5-HT2C受体激动剂间氯苯哌嗪时,海绵体神经兴奋和勃起增加。Kimura等(2006)应用一种新型的5-HT 2C受体激动剂(YM 348)和拮抗剂SB 242084,证实了5-HT2C受体刺激对大鼠的促勃起作用。在大鼠中5-HT、多巴胺、催产素和黑皮质素通路参与了阴茎勃起的诱导。Kimura团队(2008)认为,腰骶部5-HT 2C受体不仅介导多巴胺-催产素-5-HT的作用,还介导黑色素皮质激素对阴茎勃起的作用,5-HT通路位于黑色素皮质激素和多巴胺-催产素通路的下游。
5-HT被认为是控制性冲动的抑制性递质(Foreman et al,1989)。服用5-HT激动剂芬氟拉明可抑制性欲,但服用5-HT神经元抑制剂丁螺环酮时性欲升高(Buffum,1982)。
⑤去甲肾上腺素:去甲肾上腺素能神经元的胞体位于脑桥和髓质中的蓝斑和α5-儿茶酚胺能细胞群。这些去甲肾上腺素能神经元的轴突向上支配下丘脑、丘脑和新皮质的室旁核、视上核和室周核,向下到达脊髓和小脑。中枢去甲肾上腺素传递能促进性功能。在人类和大鼠中,α2-肾上腺素受体激动剂可乐定对去甲肾上腺素释放的抑制与性行为的减少有关,而α2受体拮抗剂育亨宾则能增加性冲动(Clark et al,1985)。β受体阻滞剂也与性功能障碍有关,可能是因为它们对中枢的不良反应,如镇静、睡眠障碍和抑郁。
⑥黑皮质素:黑皮质素-4受体(MC4R)参与控制食物摄入和能量消耗,调节勃起功能和性行为。支持这一观点的证据有以下几个方面。一是非肽类MC4R激动剂能增强野生型(而非MC4R-null)小鼠海绵体神经冲动所引起的勃起活动;二是选择性MC4R激动剂可增强小鼠的交配行为,但对缺乏MC4R的小鼠,其交配行为明显减弱;三是反转录聚合酶链式反应和非聚合酶链反应方法显示,MC4R在大鼠和人的阴茎、大鼠脊髓、下丘脑、脑干和骨盆神经节(主要的自主神经中枢到阴茎)中表达,而在大鼠阴茎海绵体平滑肌细胞中没有表达;四是人和大鼠阴茎头组织原位杂交结果显示,MC4R在阴茎头神经纤维和机械感受器中表达。这些数据表明,MC4R参与了阴茎勃起功能的调节,并证明MC4R介导的促勃起反应可能是通过脊髓勃起中枢和阴茎体感传入神经末梢的神经回路激活的(Van der Ploeg et al,2002)。
⑦催乳素:催乳素水平的增加抑制了男性和实验动物的性功能(Rehman et al,2000)。在大鼠中,高水平的催乳素可降低生殖反射,并干扰交配行为。提示催乳素的作用机制是通过抑制MPOA的多巴胺能活性和降低睾酮而发挥作用。此外,催乳素可能通过收缩海绵状平滑肌对阴茎产生直接影响(Ra et al,1996)。在研究有ED的已婚男性的性活动时,发现ED男性的平均催乳素水平显著升高(Paick et al,2006)(表6-8)。
表6-8 中枢神经递质及其功能

