(四)组织学分类
GCTs的组织学分类见框图14-2(Sobin and Wittekind,2002)。GCTs大体上分为精原细胞瘤和NSGCT,其相对分布比例分别为52%~56%和44%~48%(McGlynn et al,2005;Powles et al,2005)。NSGCT包括胚胎癌(EC)、卵黄囊瘤、畸胎瘤和绒毛膜癌等亚型,可能以单纯某类型出现,也可以伴或不伴精原细胞瘤的混合型GCT组合出现(Ulbright,2005)。大多数NSGCT是由两种或更多种GCT亚型组成的混合肿瘤,包含NSGCT亚型和精原细胞瘤的GCTs被归类为NSGCT。

框图14-2 生殖细胞肿瘤WHO分类
From Sobin LH,Wittekind CH.UICC:TNM classification of malignant tumors.6th ed.New York:Wiley-Liss;2002.
1.生精小管内生殖细胞肿瘤(intratubular germ cell neoplasia,ITGCN)
除母细胞性精原细胞瘤外,所有成人侵袭性GCTs均来自lTGCN。ITGCN由未分化的生殖细胞组成,位于生精小管基底部,具有精原细胞瘤的外观。生精小管通常表现为精子发生减少或缺失,正常成分被ITGCN所取代。在睾丸癌睾丸切除标本中存在ITGCN对于复发风险没有任何预后意义(von Eyben et al,2004)。ITGCN在儿童患者GCTs中发生概率较低(Cheville,1999)。
2.精原细胞瘤
精原细胞瘤是最常见的GCT类型。一般而言,精原细胞瘤的发病年龄大于NSGCTs,大多数诊断病例在40-50岁(Cheville,1999)。大体标本上,精原细胞瘤是一种柔软的棕褐色至白色弥漫性或多结节样肿块(图14-1A)。可存在坏死,但通常为局灶性,并不像其他GCT那样突出。精原细胞瘤由层状排列的肿瘤细胞构成,肿瘤细胞有多边形细胞核和透明细胞质,被含有淋巴细胞的纤维血管组织分隔成巢状(图14-1B)(Ulbright,2005)。人绒毛膜促性腺激素(hCG)染色阳性的合胞体滋养细胞可以在大约15%的病例中被发现,但是对预后没有明确的意义(Cheville,1999)。淋巴细胞浸润和肉芽肿性反应很常见,而且精原细胞瘤似乎与结节病的发病率增加有关(Rayson et al,1998;Tjan-Heijnen et al,1998)。精原细胞瘤可能与实性的EC、卵黄囊瘤或支持细胞肿瘤相混淆(Ulbright and Young,2008)。尽管免疫组织化学染色在诊断GCT中的作用有限,但精原细胞瘤中CD30呈典型的阴性,CD117呈阳性,而胎盘碱性磷酸酶(PLAP)呈强阳性。间变性精原细胞瘤是先前公认的精原细胞瘤亚型,但这种区分没有明确的生物学或临床意义,不再被认可。精原细胞瘤起源于lTGCN,被认为是其他NSGCT亚型的共同前体(Ulbright,2004)。精原细胞瘤转化为NSGCT成分的这种能力对精原细胞瘤的治疗具有重要的意义(稍后讨论)(Ulbright,2004)。
3.精母细胞性精原细胞瘤
精母细胞性精原细胞瘤很少见,占GCT不到1%。虽然分类为精原细胞瘤的变异体,但这些肿瘤却代表了一种与其他GCTs不同的临床病理学实体。与其他GCTs相比,精母细胞性精原细胞瘤并非来自lTGCN,也与隐睾症或双侧性疾病病史无关,不表现为i(12p),也不是作为混合GCT的一部分发生(Ulbright,2005)。组织病理学上,它们与精原细胞瘤的不同之处在于PLAP或糖原(过碘酸-希夫染色)染色阴性;细胞核圆形;淋巴细胞浸润很轻微;并且存在三种不同的细胞类型,包括小淋巴细胞样细胞,具有致密嗜酸性细胞质和圆形核的中等大小细胞及大单核细胞或多形核细胞(Aggarwal and Parwani,2009)。发病高峰在60岁左右(Eble,1994;Chung et al,2004a)。这是一种良性肿瘤(仅有3例有转移记录),且几乎均可以通过睾丸切除术治愈(Chung et al,2004a;Horn et al,2011)。一种例外是十分罕见的精母细胞性精原细胞瘤伴肉瘤,其表现为肉瘤分化的成分和精母细胞性精原细胞瘤的间变性变异体;这两种实体都与广泛转移性化疗耐药性疾病和不良预后相关(Dundr et al,2007;Narang et al,2012;Wetherell et al,2013)。
4.胚胎癌(embryonal carcinoma,EC)
EC由未分化的恶性细胞组成,该细胞类似于具有拥挤的多形核的早期胚胎原始上皮细胞(Ulbright,2005)。大体上来看,EC是一种棕黄色肿瘤,常常表现出大面积的出血和坏死。这些肿瘤的显微外观差异很大,它们可能以实体层状或乳头状腺泡状或管状形式生长(图14-1C)。某些病例中可发现合胞体滋养层。EC是一种侵袭性肿瘤,伴有高转移率,而常常血清肿瘤标志物却正常。EC是NSGCT中未分化程度最高的细胞类型,无论是在原发肿瘤内或转移部位,均具有全能分化为其他NSGCT细胞类型的能力(包括畸胎瘤)。如后面要讨论的,EC的存在和比例与临床分期(CS)Ⅰ期NSGCT中隐匿性转移的风险增加有关。典型的EC通常AE1/AE3、PLAP和OCT3/4染色阳性,而c-KIT染色阴性。
5.绒毛膜癌
绒毛膜癌是一种罕见的侵袭性肿瘤,通常表现为极高的血清hCG水平和病灶的播散。由于其血清hCG水平和(或)肺外器官的转移,这些肿瘤在诊断时通常被认为是预后不良(ⅢC)(Alvarado-Cabrero et al,2014)。绒毛膜癌通常通过血行途径传播,并且转移的常见部位包括肺、肝和脑(Tinkle et al,2001;Allen,2002;Osada et al,2004;Yokoi et al,2008;Alvarado-Cabrero et al,2014;Alvarado-Cabrero et al,2014)。显微镜下,肿瘤由合胞体滋养层和细胞滋养层组成,前者hCG染色阳性(图14-1D)(Cheville,1999)。精原细胞瘤和EC也可能含有合胞体滋养层。睾丸绒毛膜癌出血和坏死区域明显。类似于妊娠滋养细胞疾病,睾丸绒毛膜癌容易出血,有时在化疗开始后即刻出现自发性出血,并且这种出血可能是灾难性的,特别是出现在肺或大脑时(Motzer et al,1987;Yokoi et al,2008;Kandori et al,2010)。另外,绒毛膜癌与激素紊乱有关,很可能是血清hCG明显升高的结果。hCG刺激甲状腺刺激素和黄体生成素的受体(它们享有共同的α亚基)可导致甲亢和雄激素生成增加(Ulbright,2005)。也有造成高催乳素血症的报道。
6.卵黄囊瘤
纯粹的卵黄囊瘤(有时称为内胚窦瘤)只占成年人性腺和腹膜后GCTs中的一小部分,在纵隔和小儿GCTs中更常见(Moran et al,1997a;Moran and Suster,1997b;Ross et al,2002;Ulbright,2005;Cao and Humphrey,2011)。混合型GCTs包含了卵黄囊瘤的成分,常由中等大小的立方上皮细胞交织成网,同时细胞内外常可见嗜酸性透明小体(Epstein,2010)。卵黄囊瘤可按腺体状,乳头状或微囊状形式生长。Schiller-Duval小体是卵黄囊瘤的一个典型特征,类似于内胚窦,在大约一半的病例中可见(图14-1E)。细胞质和细胞外的嗜酸性透明小体是另一个特征性组织学表现,可在84%的病例中存在。卵黄囊瘤几乎总是产生AFP而不是hCG。
7.畸胎瘤(https://www.daowen.com)
畸胎瘤是包含三种生殖细胞层(内胚层、中胚层和外胚层)中至少两种分化良好或不完全分化成分的肿瘤,特点为具有混合的组织成分。高分化肿瘤标记为成熟畸胎瘤,而不完全分化(即与胎儿或胚胎组织相似)的肿瘤被标记为未成熟畸胎瘤。在青春期男孩和成年男性中,成熟畸胎瘤和未成熟畸胎瘤之间的区别并没有临床意义,组织病理学家通常不会区分这两种实体病变。成熟畸胎瘤可能包括成熟的骨骼,软骨,牙齿,头发和鳞状上皮的成分(这或许解释了畸胎瘤的名称,这在希腊文中大致意思是“怪物肿瘤”)(图14-1F)。畸胎瘤的总体外观很大程度上取决于其中的成分,大多数肿瘤具有实性和囊性区域。畸胎瘤的血清肿瘤标志物往往正常,但可能引起血清AFP水平轻度升高。大约47%的成年混合GCTs含有畸胎瘤;纯型畸胎瘤并不常见(Leibovitch et al,1995b;Simmonds et al,1996)。
在男性中,畸胎瘤具有良性组织学表现,但其常常在进展性NSGCT患者的转移部位发现。畸胎瘤对化疗耐药。鉴于其在进展性NSGCT转移灶中频繁存在,化疗后残留肿块的患者需要进行巩固性手术切除。畸胎瘤固有的化疗耐药性导致了NSGCT患者单独使用化疗治疗策略的局限性。
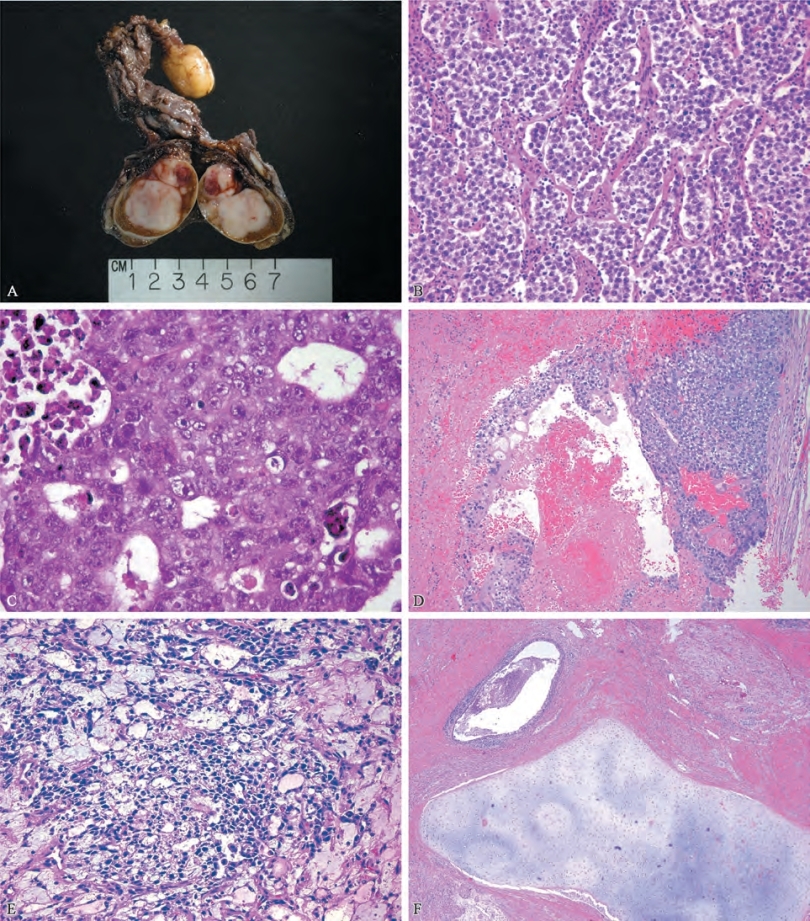
图14-1 A.包含精原细胞瘤的睾丸大体解剖。B.精原细胞瘤 [苏木精-伊红(H&E)染色]。C.胚胎癌(H&E染色)。D.绒毛膜癌(H&E染色)。E.卵黄囊瘤(H&E染色)。F.畸胎瘤(H&E染色)
尽管畸胎瘤具有良性的组织学表现,但畸胎瘤含有许多常见于恶性GCT的遗传异常,包括非整倍体,i(12p)和相当多变的增殖能力(Castedo et al,1989;Sella et al,1991)。研究还表明,畸胎瘤囊液通常含有h CG和AFP,证明其有恶性潜能(Sella et al,1991;Beck et al,2004)。畸胎瘤的遗传不稳定性具有重要的临床意义。畸胎瘤可能无法控制地生长,侵入周围结构,并变得无法切除(称为成长性畸胎瘤综合征)(Logothetis et al,1982)。在极少数情况下,畸胎瘤可能转变为体细胞型恶性肿瘤,如横纹肌肉瘤、腺癌或原始神经外胚层肿瘤(Little et al,1994;Comiter et al,1998;Motzer et al,1998)。这些肿瘤被称为体细胞型恶性畸胎瘤或恶变的畸胎瘤。这些肿瘤常常存在i(12p)异常,表明它们来自GCT。恶变的畸胎瘤是高度侵袭性的,耐受常规化疗,并且与不良预后相关(Comiter,1998;El Mesbahi et al,2007)。最后,进展性NSGCT患者未切除的畸胎瘤可能导致晚期复发(Sheinfeld,2003)。所有这些事件都可能导致死亡。
要点:生殖细胞肿瘤
•GCT是20-40岁男性最常见的实体肿瘤。
•双侧GCT发生率为2%,通常表现为双侧不同步发生。
•GCT在白人发生率最高而在非裔美国人最低。
•隐睾,GCT个人史或家族史和ITGCN是已知的GCT危险因素。
•青春期前隐睾切除术有利于降低GCT发生风险。
•大约70%的GCTs有12号染色体或者i(12p)的额外拷贝数,此遗传标志物可以用于GCT和起源于畸胎瘤恶变的非GCT性体细胞型恶性肿瘤的病理组织学诊断。
•大约5%GCTs起源于性腺外,最常见的部位是纵隔和腹膜后。原发性纵隔NSGCTs预后不良。
•畸胎瘤组织学上为良性。转移部位的畸胎瘤起源于转移性胚胎癌的分化。
•畸胎瘤对化疗具有抵抗。
•畸胎瘤组织学上是良性的,但遗传并不稳定,有不可预测的生物学行为。尽管罕见,畸胎瘤可以快速生长并发生内胚层、中胚层、外胚层成分的恶变,形成非GCT性体细胞型恶性肿瘤。
