诊断和初期管理
1.阴囊超声检查
当男性出现睾丸肿块、鞘膜积液或不明原因的阴囊症状或体征时,阴囊超声检查应被视为体格检查的延伸,因为它应用非常普及,价格低廉且无创。随着高频探头(5~10MHz)的应用,阴囊超声可以识别几毫米大小的睾丸内病变,比较容易与睾丸外病变进行区分。在超声扫描中,典型的GCT表现为低回声,并且可以识别2个或更多散发的病灶(图14-2)。由于精原细胞瘤通常具有均匀的回声纹理,因此病变内的异质回声更常与NSGCT相关。彩色多普勒超声检查发现病灶内血流增加表明有恶性肿瘤,尽管血流信号低并不能够排除GCT。睾丸微石症和GCT之间并没有明确的关联,单纯这个发现不应促使进一步的评估(DeCastro et al,2008)。鉴于双侧GCT的发生率为2%,双侧睾丸均应进行超声检查,尽管诊断为双侧肿瘤很少见(占所有GCT的0.5%),且异时性表现更常见(Fossa et al,2005)。
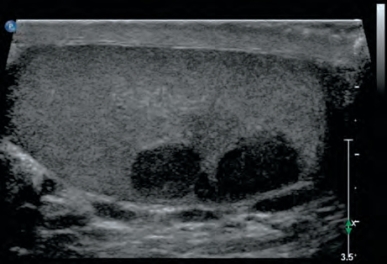
图14-2 左侧睾丸超声矢状面显示存在睾丸内多发结节低回声病变,睾丸切除术证实为单纯精原细胞瘤
对于睾丸体检正常的进展性GCT男性,应该进行阴囊超声检查以排除存在小的,不可察觉的瘢痕或钙化,这些发现提示有可能存在“退变的”原发性睾丸肿瘤。GCT是最常见的自发性消退肿瘤之一,精原细胞瘤是最常见的亚型(Balzer and Ulbright,2006)。对于睾丸内病变存在超声证据(散发结节、星状瘢痕、粗颗粒钙化)的患者应常规进行根治性睾丸切除术,因为经常会遇到ITGCN和残余畸胎瘤。在体格检查和超声扫描中正常睾丸的进展性GCT患者被认为是具有原发性性腺外GCT。
在GCT没有播散或血清肿瘤标志物没有升高时,小的(<10mm)、不可触及的睾丸内病变的诊断可能是一个难题。尽管其中20%~50%可能代表小GCTs(通常是精原细胞瘤),但这些病变中的大多数是良性的(睾丸囊肿、小梗死、Leydig细胞结节或小Leydig细胞或Sertoli细胞肿瘤)(Hindley et al,2003;Connolly et al,2006;Muller et al,2006;Shilo et al,2012)。恶性肿瘤的风险随着病灶大小的增加而增加,<1cm的病变的恶性概率为50%,而1~2cm的病变的恶性概率超过80%(Carmignani et al,2005)。治疗选择包括经腹股沟的睾丸切除术、经腹股沟探查和保留睾丸的切除手术(冰冻切片分析排除GCT)及后续定期的超声检查(发现是否有增大的病灶)。术中可以用超声定位睾丸病变。
2.肿瘤血清标志物
睾丸癌是与血清肿瘤标志物[乳酸脱氢酶(LDH)、AFP和hCG]相关联的少数恶性肿瘤之一,其在诊断和治疗中必不可少(Gilligan et al,2010)。血清肿瘤标志物水平应在诊断时、睾丸切除术后,观察患者对化疗的反应及在随访观察和治疗完成后的复发情况时进行检测。
在诊断时,在50%~70%的低分期(临床Ⅰ,ⅡA和ⅡB期)NSGCT和60%~80%的进展期(临床ⅡC和Ⅲ期)NSGCT患者中存在AFP水平升高。EC和卵黄囊瘤分泌AFP。绒毛膜癌和精原细胞瘤不产生AFP。原发性肿瘤中伴有血清AFP升高的单纯精原细胞瘤的患者被认为具有NSGCT。AFP的半衰期为5~7d。以下患者AFP水平也可能增加:肝细胞癌,胃癌,胰腺癌,胆管癌和肺癌;非恶性肝病(传染性、药物诱导、酒精诱导的、自身免疫);无菌性毛细血管扩张症;遗传性酪氨酸血症。
在20%~40%的低分期NSGCT和40%~60%的进展期NSGCT患者中存在hCG水平升高。大约15%的精原细胞瘤分泌hCG。hCG也可由绒毛膜癌和EC分泌。hCG水平>5000U/L通常与NSGCT有关。hCG的半衰期为24~36h。在肝癌、胆管癌、胰腺癌、胃癌、肺癌、乳腺癌、肾癌和膀胱癌中,h CG水平可能升高。由于h CG的α亚基在多种垂体肿瘤中共同存在,因此hCG的免疫测定是针对其β亚基。hCG与黄体生成素的交叉反应性会导致原发性性腺功能减退症患者的hCG呈假阳性升高。性腺功能减退症引起的血清hCG升高,往往在给予睾酮后48~72h正常化,这可以作为区分hCG真阳性和假阳性的方法。大麻的使用也可能导致hCG结果呈假阳性。
在大约20%的低分期GCT和20%~60%的进展期GCT患者中LDH水平升高。LDH在平滑肌、心肌和骨骼肌中表达。淋巴瘤也可能导致LDH水平升高。在LDH的5种同工酶中,LDH-1是GCT中最常见升高的同工酶。LDH-1水平与染色体臂12p拷贝数相关,这在GCT中经常被放大。LDH升高的程度与大部分疾病相关。作为GCT的非特异性标志物,其主要用途是在诊断GCT时评估其预后。LDH的血清半衰期为24h。
疑似患有GCT的患者应该在进行睾丸切除术前抽取血清检测AFP、hCG和LDH等以协助诊断,并有利于解释睾丸切除术后的肿瘤标志物水平变化。为了肿瘤分期的目的,应该了解睾丸切除术之前获得的血清肿瘤标志物水平在睾丸切除术后是否下降,以及下降有多快。血清肿瘤标记物检测结果不应作为是否行根治性睾丸切除术的决策因素,因为AFP或hCG水平在正常范围内也不排除GCT。如果组织病理学诊断为单纯精原细胞瘤,而血清AFP显著升高可以确定NSGCT的诊断,因为精原细胞瘤不产生AFP。但是,应该小心谨慎地解释标志物处于“临界值”的原因。某些罕见的具有睾丸、腹膜后或纵隔原发性肿瘤的患者,其疾病负荷需要立即开始治疗,血清AFP和/或hCG的显著升高可被认为足以诊断GCT。对于这种罕见的,医学上不稳定的患者,治疗不要延迟,可以在组织学给出诊断之前进行。然而,这些患者在完成化疗后应该接受根治性睾丸切除术,因为睾丸由于血-生精小管屏障(血-睾屏障)使其成为是一个恶性GCT的避难所,常常含有残留的侵袭性GCT,畸胎瘤或ITGCN(Geldart et al,2002)。
3.经腹股沟根治性睾丸切除术
疑似患有睾丸肿瘤的患者应该进行根治性睾丸切除术,并将含有肿瘤的睾丸和精索切除至腹股沟内环的水平。禁用经阴囊睾丸切除或活检,因其使精索的腹股沟部分保持完整,并可能改变睾丸的淋巴引流,增加局部复发和盆腔或腹股沟淋巴结转移的风险。由于GCTs的快速生长,应及时进行睾丸切除术;即使延迟1~2周也应该避免。根治性睾丸切除术可确定组织学诊断和原发性T分期,提供肿瘤组织学的重要预后信息,可治愈80%~85%临床Ⅰ期精原细胞瘤的和70%~80%临床Ⅰ期的NSGCT患者。
睾丸的组织病理学检查应确定肿瘤的组织学类型(框图14-2)(Sobin and Wittekind,2002)、肿瘤大小、多灶性、局部肿瘤浸润(睾丸网、白膜、鞘膜、附睾、精索、阴囊)、原发性T分期(表14-1)(Greene et al,2002;Sobin and Wittekind,2002)、ITGCN的存在、血液或淋巴管侵袭(称为脉管浸润)和手术切缘状况。对于混合型GCT患者,应确定每个单独的肿瘤亚型,包括其相对比例。由于GCT的相对稀少性以及原发性肿瘤组织学对治疗决策的重要性,因此推荐由有经验的病理学家对原发性肿瘤标本进行审阅(Krege et al,2008a,2008b)。在一项随机多中心临床试验中,382例NSGCT标本中有5例(1.3%)通过“集中病理阅片”重新分类为精原细胞瘤(Albers et al,2008)。(https://www.daowen.com)
表14-1 TNM Staging of Testicular Tumor:American Joint Committee on Cancer and Union lnternationale Contrele Cancer

(续 表)

(续 表)
*Except for p Tis and p T4,extent of primary tumor is classified by radical orchiectomy.Tx may be used for other categories in the absence of radical orchiectomy.
†N indicates the upper limit of normal for the LDH assay.
AFP,α-fetoprotein;hCG,human chorionic gonadotropin;LDH,lactate dehydrogenase;RPLND,retroperitoneal lymph node dissection.
From AJCC.Testis.In:Edge SE,Byrd DR,Compton CC,editors.AJCC cancer staging manual.7th ed.New York:Springer;2010.p.469-73.Used with permission of the American Joint Committee on Cancer (AJCC),Chicago,Illinois.The original source for this material is the AJCC Cancer Staging Manual,Seventh Edition (2010),published by Springer Science and Business Media,LLC,www.springer.com.
4.保留睾丸的手术
保留睾丸的手术(或睾丸部分切除术)具有高度争议性,并且在有正常对侧睾丸的睾丸肿瘤患者治疗中没有意义。然而,对于肿瘤在双侧睾丸或在孤立性睾丸但伴有充足的雄激素合成的患者,若为不超过2~3cm(30%睾丸体积)的局限性肿瘤,可考虑保留睾丸。当病变不超过3cm且血清AFP、hCG和LDH正常时,也应考虑到可能为良性肿瘤或不确定病变,因为此时为良性组织学结果的可能性为80%(Giannarini et al,2010)。保留睾丸手术对于较大的肿瘤(>3cm)可行性不高,因为完整切除肿瘤常常使残留的睾丸实质不足以保存。当进行保留睾丸手术时,进行术中冰冻切片分析可在大多数情况下区分组织学良性和恶性(Tokuc et al,1992;Elert et al,2002)。应该进行相邻睾丸实质活检以排除lTGCN的存在。对于lTGCN患者,应用20Gy或更高剂量对残留睾丸进行辅助放射治疗通常足以防止GCT的发展,同时可以保留睾丸Leydig细胞功能(和睾丸雄激素生成)。在该剂量下的辐射可导致睾丸永久性不育。Leydig细胞功能可能会随着时间的推移而下降,接受放射治疗的男性中有40%需要补充睾酮(Petersen et al,2002)。德国睾丸癌研究小组报道,46例器官局限性小肿瘤患者在接受保留睾丸手术和ITGCN辅助放疗后没有局部复发病例(中位随访时间91个月)(Heidenreich et al,2001)。相反,5例没有接受辅助放疗的患者,4例发生了复发性睾丸癌。如果希望考虑生育问题,辅助放疗可在保留睾丸的手术后适当延迟,但必须密切随访(Giannarini et al,2010)。
5.对侧睾丸活检
在GCT患者中,正常对侧睾丸有5%~9%的可能性具有ITGCN(Dieckmann and Skakkebaek,1999)。在存在睾丸萎缩,隐睾病史或年龄<40岁的患者中,对侧睾丸中ITGCN的发病率为36%(Dieckmann and Loy,1996)。对于有ITGCN危险因素的患者或术前超声扫描存在可疑病变的患者,可考虑对侧睾丸进行经腹股沟开放活检(Motzer et al,2006)。
6.疑似性腺外生殖细胞肿瘤
大约5%的GCT来自性腺外(Bokemeyer et al,2002b)。无睾丸肿块的转移性GCT患者中,只有1/3的患者被明确诊断为原发性的性腺外GCT;1/3的患者在睾丸中有ITGCN,1/3的患者有超声检查证据表明有退变的原发肿瘤(Scholz et al,2002)。任何具有中线区域包块的40岁以下男性都应考虑GCT。在正常的睾丸评估基础上,出现血清AFP和(或)hCG升高,就足以诊断GCT,并且在开始治疗之前不需要进行组织学活检确认。如果血清肿瘤标志物正常,应在开始治疗前进行肿块活检以确认GCT的诊断。如果肿瘤原发部位无法确诊,活检标本显示低分化癌则会为诊断带来困难。在这种情况下,恶性转化的性腺外GCT需要被考虑,活检标本中i(12p)的表达则支持这一诊断。如果其转移模式与右侧或左侧睾丸原发肿瘤一致或者有超声证据显示为退变的原发肿瘤,那么怀疑有性腺外GCT的患者在治疗过程中的某一时间点应该进行经腹股沟睾丸切除术。
要点:生殖细胞肿瘤的诊断和初始管理
•除非另有证据,否则青春期后男性患者睾丸内的实性肿块应被视为GCT。
•除极少数例外情况,怀疑患有GCT的男性应行经腹股沟高位精索结扎及睾丸切除术。应避免行经阴囊睾丸切除术和活检。
•对某些特定GCT患者可以考虑行保留睾丸手术,这类患者存在孤立性睾丸或同时双侧睾丸小肿瘤,并且保留的患侧睾丸可以提供足够的雄激素。
•在GCT中延误诊断很常见,大约1/3的病例初诊延误。
•如果血清肿瘤标志物水平在睾丸切除术之前升高,则应在睾丸切除术后对其进行检测,以确定其水平是否下降、稳定或上升。睾丸切除术前获得的血清肿瘤标志物水平不应用于治疗决策。
