(八)治疗
1.治疗原则
GCT的管理决策取决于肿瘤迅速增长的潜力和基本上所有患者可被治疗的潜力。这意味着我们需要尽快地做出诊断和分期并采取恰当的治疗,这样可以避免患者不必要的死亡和治疗的不良反应。睾丸切除术后,应当进行影像学分期、血清肿瘤标志物检测,然后尽快制订治疗计划,以便合理执行。
该肿瘤即使是转移也有治愈的可能,故应当采取积极的治疗措施,包括化疗及化疗后残余肿块的切除。无论患者是白细胞减少还是血小板减少,通常需要实施化疗,即使是在患者出现中到重度肾功能不全的情况下,肾毒性的化疗药物(顺铂)也仍然应该应用(Williams et al,1987;Einhorn et al,1989;Bajorin et al,1993;Loehrer et al,1995;Bokemeyer,et al,1996b;Nichols et al,1998;de Wit et al,2001)。同样,NSGCT在化疗之后,即使肿瘤涉及多个解剖部位,仍然应当手术切除残余组织。年轻和总体健康状况良好的GCT患者,如果需要,应实施积极的治疗措施。
血清肿瘤标志物对GCT的治疗影响很大,尤其是NSGCT。正如之前讨论的,睾丸切除术后血清AFP或hCG升高表明存在转移性疾病,这些患者应优先进行化疗。对于接受化疗的患者,在治疗期间或治疗后的血清肿瘤标志物的升高通常分别表示难治性和复发性病变。如前所述,化疗开始时的血清AFP、hCG和LDH水平是重要的预后因素,并影响化疗方案的选择和持续时间(International Germ Cell Consensus Classification,1997)。
要点:临床分期
•睾丸GCT遵循一种可预测的模式转移扩散,从原发性肿瘤转移到腹膜后淋巴结再到远处转移。
•左侧肿瘤最主要的侵袭部位是主动脉旁和左肾门淋巴结,而右侧肿瘤是最主要的侵袭部位是主动脉与腔静脉之间和腔静脉旁淋巴结。
•尽管对于临床Ⅰ期的NSGCT和精原细胞瘤患者,包块以1cm为分辨界限时,CT影像学的假阴性发生率分别为25%~35%和14%~20%,CT仍是腹膜后病变分期的最佳方式。
•在无腹膜后淋巴结病变或血清肿瘤标志物水平升高的情况下,胸部X线平片和胸部CT是可接受的肿瘤分期方式。
•睾丸切除术后血清肿瘤标志物水平升高表明存在转移性GCT,此类患者应接受化疗。
•国际生殖细胞肿瘤协作组(IGCCCG)风险分类用于评估转移性GCT患者的预后和决定化疗方案的选择。对于NSGCT,IGCCCG风险根据睾丸切除术后血清肿瘤标志物水平,纵隔原发肿瘤和肺外内脏转移的情况决定。对于精原细胞瘤,IGCCCG风险只根据肺外内脏转移灶出现的情况决定。
•在RPLND、化疗或放疗之前,应该向所有患者提供精子冷冻保存,因为这些治疗对生育具有潜在影响。
睾丸癌是一种相对罕见的疾病,普通泌尿外科医师和普通肿瘤科医师通常不会治疗大量GCT。此外,治疗方案复杂且微妙,支持某些治疗的数据(如RPLND)仅来自于此类手术量较多的小部分外科医师(Donohue,1993,1995;Heidenreich,2003;Stephenson,2005b;Williams,2009b)。美国的大多数泌尿外科住院医师在结束培训时仅完成了2次或更少的RPLND(Lowranceetal,2007)。多项研究显示,在处理过大量此类患者的医疗机构中,患者生存改善更好(Aass et al,1991;Harding et al,1993;Feuer et al,1994;Collette et al,1999;Joudi and Konety,2005;Suzumura et al,2008)。只要有可能,GCTs患者应该在处理过大量此类患者的机构接受治疗,RPLND应由有此操作经验的外科医师执行。
2.精原细胞瘤和NSGCT的治疗对比
以治疗为目的,区分精原细胞瘤和NSGCT非常重要。与NSGCT相比,精原细胞瘤有较有利的自然病史。通常来讲,精原细胞瘤的侵袭性较低,更容易早期诊断,并可预测其沿淋巴管扩散到腹膜后,然后通过血液扩散到肺或其他器官。在疾病诊断时,临床Ⅰ、Ⅱ、Ⅲ期患者的比例在精原细胞瘤中分别为85%、10%、5%,在NSGCT中分别约为33%、33%、33%(Powles et al,2005)。临床Ⅰ期精原细胞瘤的患者隐匿性转移发生率较低(精原细胞瘤∶NSGCT为10%~15%∶25%~35%),并且腹膜后病变治疗后全身复发的风险较低(精原细胞瘤放疗后为1%~4%,而NSGCT在RPLND后为10%),此种情况应用化疗具有重要意义。精原细胞瘤血清肿瘤标志物升高的可能性小,并且血清肿瘤标志物的范围不如NSGCT波动大。此外,血清肿瘤标志物不应用于精原细胞瘤的IGCCCG风险分类。
与NSGCT相比,精原细胞瘤对放疗和铂类化疗极度敏感。与其他实体瘤相比,根除精原细胞瘤需要的辐射剂量较低。放射治疗是临床Ⅰ期,ⅡA和ⅡB期精原细胞瘤的标准治疗选择,但对NSGCT无效,仅对脑转移瘤有作用。尽管精原细胞瘤占所有GCT病例的52%~56%,但仅占晚期GCT的10%。对晚期精原细胞瘤而言,其在IGCCCG风险类别中不存在预后不良,90%以上的转移病例被归类为低危(NSGCT的比率为56%)(International Germ Cell Consensus Classification,1997)。对晚期精原细胞瘤而言,通常不考虑远处转移部位发生畸胎瘤的风险,这对于化疗后残留肿块的处理有重要意义。但是对于化疗效果差或者放疗后复发的患者,需要考虑病变由精原细胞瘤向NSGCT成分转化的可能。治疗后复发的远处转移性精原细胞瘤患者,10%~15%的患者在复发部位具有NSGCT成分。尸检研究表明,死于精原细胞瘤的患者,30%在转移部位具有NSGCT成分(Bredael et al,1982)。
对于晚期NSGCT患者,转移部位的畸胎瘤风险对治疗方案有重要影响,并且对于具有晚期病变的患者经常需要化疗后进行手术(postchemotherapy surgery,PCS)。对于低分期的NSGCT,由于腹膜后畸胎瘤的风险也使得许多临床医师在远处隐匿性转移风险较低的情况下仍倾向于进行RPLND而非化疗。如前所述,畸胎瘤对化疗不敏感,而转移性畸胎瘤患者的预后与手术切除的完全性有关。
由于GCT几乎总是可以治愈,因此大量的临床试验以尽量将治疗减少到最低限度,避免不必要的治疗为目的,以减少短期和尤其是长期的不良反应和毒性。一种方法是限制接受两种干预措施(“双重治疗”)的患者人数:要么手术,要么化疗,而不是两者兼有。然而,由于NSGCT通常是混合型肿瘤,并且畸胎瘤通常存在于转移部位并有其他GCT成分,因此“治愈”通常需要化疗来杀灭化疗敏感成分并进行手术切除畸胎瘤。人们普遍认为,全身治疗和化疗后手术的成功整合是过去几十年转移性GCT治愈率提高的主要因素。虽然尽量减少不必要的治疗是一个重要目标,但化疗、放疗和CT检查与继发性恶性肿瘤和(或)心血管疾病的终身性风险增加有关(Meinardi et al,2000;Zagars et al,2004;Brenner and Hall,2007;van den Belt-Dusebout et al,2007;Tarin et al,2009)。相反,由有经验的外科医师进行的RPLND与长期毒性作用的降低相关联。
要点:精原细胞瘤和NSGCT的对比
•与NSGCT相比,精原细胞瘤具有惰性自然病史,临床Ⅰ、ⅡA和ⅡB期患者的转移发生率较低,隐匿性腹膜后远处转移的发生率较低。
•根据IGCCCG标准,与NSGCT相比,转移性精原细胞瘤的预后没有高危类别,更多的转移性精原细胞瘤患者被划分为低危。
•与NSGCT相比,精原细胞瘤对放疗和铂类化疗具有更高的敏感性。
•在转移性精原细胞瘤患者中,仅有15%的患者血清hCG升高,而血清肿瘤标志物水平不用于指导治疗决策。
•与NSGCT相比,不太需要顾虑精原细胞瘤的转移部位出现畸胎瘤的可能性,但对常规治疗无效的患者,应考虑到其可能性。
3.生精小管内生殖细胞瘤(ITGCN)
ITGCN的诊断是通过对不育患者的睾丸活检,GCT患者的对侧睾丸活检,或对保留睾丸手术患者的患侧睾丸活检来明确。治疗ITGCN的基本原理是基于侵袭性GCT发展的高风险性(Skakkebaek et al,1982;Dieckmann and Skakkebaek,1999)。治疗方案包括睾丸切除术、低剂量放疗和密切观察。根据患者对未来生育的需求,对侧睾丸是否正常及患者是否希望避免睾酮替代治疗,进行个体化治疗。尽管低剂量放疗(≥20Gy)与手术具有相似的局部控制率,而且具有保留睾丸内分泌功能的机会,因为睾丸间质细胞和生殖上皮相比具有一定的放射抵抗性,但是根治性睾丸切除术仍是最确切的治疗方法(Heidenreich et al,2001;Montironi et al,2002;Dieckmann et al,2003)。然而,多达40%的患者最终需要睾酮替代治疗,放疗后应监测患者睾丸雄激素水平(Heidenreich et al,2001;Petersen et al,2002)。为了保留睾丸内分泌功能,已有研究将放射剂量减少至20Gy以下,但是减小剂量可能出现ITGCN复发(Classen et al,2003;Dieckmann et al,2003)。对于具有生育要求的对侧睾丸功能正常的患者,首选根治性睾丸切除术,因为放疗辐射可能会损害对侧睾丸的精子发生。对于精液参数异常但足以用于辅助生殖的患者,通过定期的睾丸超声评估,进行密切监测是一种合理的延迟治疗策略,直到成功妊娠和(或)GCT发展。这些患者的另一种选择是睾丸探查,采集精子和用于辅助生殖技术的冷冻保存以及根治性睾丸切除术后进行睾酮替代治疗。
计划接受顺铂化疗的ITGCN患者是一种独特的情况,因为化疗可能会降低(但不能消除)GCT的风险。一项研究评估ITGCN患者化疗后睾丸GCT的风险在5年时为21%,在10年时为45%(Christensen et al,1998)。这些患者可以在化疗完成后接受小剂量放疗,或者化疗后2年或更长时间后,对于有ITGCN证据的患者,进行睾丸活检确诊,然后治疗(Krege et al,2008a,2008b)。
要点:生精小管内生殖细胞瘤
•ITGCN是GCT的前驱病变,5年内发生侵袭性GCT的风险为50%。
•根治性睾丸切除术和低剂量(≥20Gy)放疗是ITGCN的有效治疗选择。
4.NSGCT
(1)临床Ⅰ期NSGCT:大约1/3的临床Ⅰ期NSGCT患者在睾丸切除术后具有正常血清肿瘤标志物。这些患者的最佳治疗方案仍然具有争议,因为采用主动监测、RPLND和化疗这三项治疗措施后的长期生存率接近100%。产生争议的是腹膜后或远处部位的隐匿性转移仅占所有患者的20%~30%。睾丸切除术后的任何可能导致短期和长期并发症的干预措施都代表针对病变局限于睾丸内的70%~80%患者的过度治疗。尽管在某些中心,无论风险如何,主动监测是首选方法,但是大多数中心采用基于隐匿性转移概率的风险适应方法。
①风险评估:许多研究试图鉴定原发肿瘤内可预测隐匿性转移的组织病理学因素。隐匿性转移最常见的危险因素是淋巴血管浸润和EC成分占主导。文献中EC成分占主导的定义为EC成分占45%~90%。报道的淋巴血管浸润和EC占主导的隐匿性转移率(基于监测中观察到复发或RPLND后淋巴结转移)分别为45%~90%和30%~80%(Heidenreich et al,1998;Sogani et al,1998;Hermans et al,2000;Sweeney et al,2000;Alexandre et al,2001;Roeleveld et al,2001;Albers et al,2003;Vergouwe et al,2003;Nicolai et al,2004;Stephenson et al,2005)。在没有这两种风险因素的情况下,隐匿性转移的风险<20%。其他明确的危险因素包括进展性病理分期、缺乏成熟畸胎瘤、无卵黄囊瘤、存在EC(不论组成百分比)、MIB-1染色百分比、肿瘤大小和患者年龄。Vergouwe及其同事(2003)对23项研究进行汇总分析,评估临床Ⅰ期NSGCT隐匿性转移的预测因子,确定淋巴血管浸润(比值比5.2),MIB-1染色超过70%(比值比4.7)和EC占主导(比值比2.8)作为最强的预测因子,并且这些因素存在于36%、55%和51%的患者中。
如前所述,在制订治疗建议时,应考虑腹部盆腔CT成像的结果,因为以1cm大小作为界值与高假阴性率相关联。在主要转移部位,腹膜后淋巴结在5~9mm就应该视为可疑区域淋巴结转移。
根据几种危险因素的存在或缺失,已经提出了许多风险和预后指数,这些指数多基于淋巴血管浸润和EC占主导(Freedman et al,1987;Read et al,1992;Heidenreich et al,1998;Sogani et al,1998;Hermans et al,2000;Alexandre et al,2001;Albers et al,2003;Nicolai et al,2004;Stephenson et al,2005)。基于淋巴血管浸润和EC占主导的低危和高危患者分类,适用于评估临床Ⅰ期患者隐匿性转移性病变的风险,不应与lGCCCG的转移性NSGCT风险分类相混淆(前文已讨论过)。这些预后模型中只有一个得到了前瞻性验证,而且都没有考虑分期CT影像的结果(Freedman et al,1987;Read et al,1992)。三项前瞻性研究提示,淋巴血管浸润和EC占主导可能与35%~55%的转移风险相关,而不是大多数早期研究所报告的50%~70%。玛格丽特公主医院的一项监测系列报道,淋巴血管浸润和(或)单纯EC患者的复发率为52%(Sturgeon et al,2011)。同样,来自不列颠哥伦比亚省和俄勒冈州波特兰的一系列研究报道,淋巴血管浸润与50%的复发率相关,而EC占主导与33%的复发率相关(Kollmannsberger et al,2010)。同样,来自斯堪的纳维亚的基于人群的监测研究报告淋巴血管浸润患者的复发率为42%(Tandstad et al,2009)。最后,尽管事实上在原发肿瘤中,有42%的患者存在淋巴血管浸润的证据,但在随机试验中,通过RPLND治疗的临床Ⅰ期NSGCT患者只有18%存在腹膜后淋巴结转移(Albers et al,2008)。这种低于预期的隐匿性转移率可能是由于对异常淋巴结和(或)判断转移分期的CT影像学检查的过细解读所致。
②主动监测:主动监测的基本原理基于以下事实:70%~80%的临床Ⅰ期NSGCT患者仅通过睾丸切除术即可治愈,并且对低风险的转移性NSGCT,能够通过化疗挽救几乎所有复发患者(International Germ Cell Consensus Classification,1997)。主动监测通过治疗对有需要的患者提供了减少治疗相关毒性的可能。主动监测相关系列研究显示,在进行RPLND和初始化疗的患者之间的总生存率和疾病特异性生存率没有区别。因此,最初的监测被认为是临床Ⅰ期NSGCT的标准治疗选择。主动监测的缺点是它复发风险最高,需要长期监测(>5年),由于密集的CT检测会增加继发性恶性肿瘤的潜在风险(Brenner and Hall,2007;Tarin et al,2009)。而且,如果患者在诊断时已接受治疗,在复发时就需要进行更加强化的治疗。
已报道超过3000例男性的监测系列研究结果,平均复发风险为28%,癌症特异性死亡率为1.2%。表14-3中总结了11个大型研究的结果(Freedman et al,1987;Read et al,1992;Gels et al,1995;Sogani et al,1998;Colls et al,1999;Sharir et al,1999;Francis et al,2000;Daugaard et al,2003;Ernst et al,2005;Tandstad et al,2009;Kollmannsberger et al,2010b;Tandstad et al,2010;Sturgeon et al,2011)。超过90%的复发发生在两年内,但1%的患者(一些报道中为5%)出现晚期复发(>5年)(Daugaard et al,2003;Sturgeon et al,2011)。在同时期更多的系列研究中,65%~75%的复发发生在腹膜后,伴或不伴血清肿瘤标志物升高(Tandstad et al,2009;Sturgeon et al,2011)。因为大多数患者出现大体积(>3cm)的腹膜后淋巴结肿大,血清肿瘤标志物升高或远处转移,诱导化疗是复发患者最常用的治疗方法。然而,具有正常血清肿瘤标志物和复发的病变仅限于存在小体积的腹膜后淋巴结增大(<3cm)的患者最初可以用RPLND进行治疗(Stephenson et al,2007)。
在已发表的系列研究中使用的主动监测时间表变化很大,没有一个时间表在生存率方面被证明优于另一个时间表。鉴于大多数复发发生在头两年内,影像学监测和化验检查在2年内应更加密集,在第3~5年频率可降低。晚期复发的风险要求主动监测超过5年,但主动监测是否应该包括CT是有争议的。在随访的前5年内,腹部盆腔CT扫描的频率在多个不同的系列研究中变化很大,从每年2~13次或更多。在第1~2年的随访中,一项每年进行2次和5次CT扫描的随机对照研究显示:在患者的生存率,IGCCCG复发风险分类或复发时临床分期方面均无显著性差异(Rustin,2007)。在已发表的系列研究中,35%~80%的患者没有依从医师制订的随访监测时间表进行监测(Howard et al,1995;Hao et al,1998;Ernst et al,2005)。
表14-3 临床Ⅰ期非精原细胞瘤主动监测系列研究
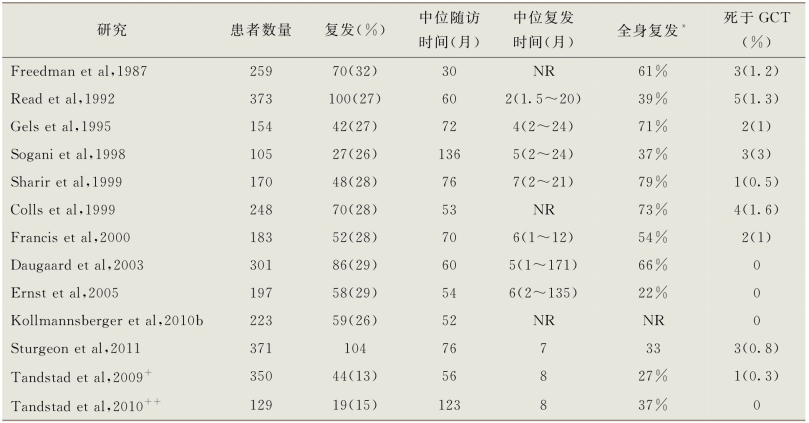
*复发伴升高的血清肿瘤标志物和(或)在腹膜后淋巴结以外的组织中复发
+97%是淋巴血管浸润和低风险
++96%为淋巴血管浸润和低风险
NR.未报告
GCT.生殖细胞肿瘤
③RPLND:RPLND治疗临床Ⅰ期NSGCT的基本原理基于以下因素:腹膜后是隐匿性转移性疾病最常见的部位,且伴有全身性病变的风险较低; 隐匿性转移患者腹膜后畸胎瘤(对化疗耐药)发生率为15%~25%; 完全的双侧标准的RPLND后腹部盆腔复发的风险低,无须行常规CT检查;对于低容积的(p N1)腹膜后恶性肿瘤和畸胎瘤患者(p N1~3),单独使用RPLND治愈率高; 如果辅助化疗仅限于广泛的腹膜后恶性肿瘤患者(p N2~3),那么超过75%或更多的患者可避免接受化疗;对于那些低危的复发和诱导化疗后复发的患者具有高挽救率;有经验的外科医师进行保留神经的RPLND时,近期和远期并发症发生率较低。在低分期NSGCT中,治疗重点是腹膜后,因为RPLND提供了最有效的癌症控制率和最低的长期严重并发症率。RPLND的缺点是所有患者都接受了大型腹部手术,这需要非常有经验的外科医师,并非所有患者能得到这样的机会,并且RPLND常常导致最高比率的双重治疗。
表14-4(Richie et al,1990;Donohue et al,1993;Hermans et al,2000;Nicolai et al,2004;Stephenson et al,2005b;Albers et al,2008;Williams et al,2009b)中总结了RPLND治疗临床Ⅰ期NSGCT的七项最大的系列研究。在这些系列研究中,病理Ⅱ期的比例为19%~28%,这些患者中估计66%~81%在RPLND后单独治愈(Donohue et al,1993;Hermans et al,2000;Sweeney et al,2000;Rabbani et al,2001;Nicolai et al,2004;Stephenson et al,2005a,2005b)。RPLND(有或无辅助化疗)的长期肿瘤特异性生存率接近100%,晚期复发的风险可以忽略不计。大多数RPLND系列研究报道的腹膜后肿瘤复发率小于2%,证明其可有效控制腹膜后转移(Donohue et al,1993;Hermans et al,2000;Stephenson et al,2005b)。
表14-4 Published Series of Retroperitoneal Lymph Node Dissection for Clinical Stage l Nonseminoma Germ Cell Tumor
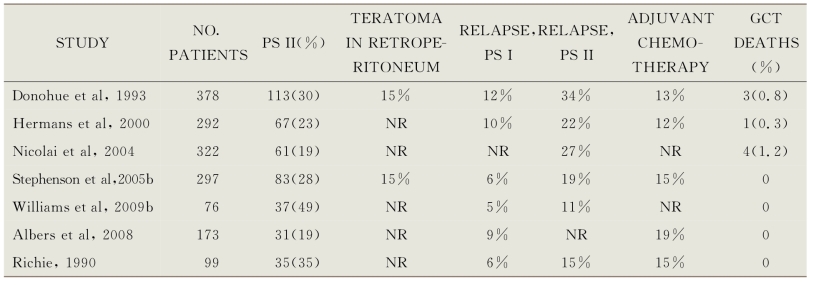
GCT,germ cell tumor;NR,not reported;PS,pathologic stage.
运用保留神经技术,完全的双侧标准的RPLND可以使腹部盆腔复发率达到最低风险(<2%)和保留最高比率的顺行射精(>90%)(Jewett et al,1990;Donohue and Foster et al,1998;Stephenson et al,2005b;Eggener et al,2007b;Subramanian et al,2010)。由于这个原因,现在许多人认为保留神经技术是初始RPLND的标准方法(Stephenson et al,2011)。针对临床Ⅰ期NSGCT,一项随机对照临床试验,对比分析了进行初始RPLND[病理性Ⅱ期患者辅助博来霉素拓扑替康/顺铂(BEP)×2治疗]和仅用BEP×1化疗的治疗结果,显示化疗对患者的2年无进展生存率有明显提高(99%vs.92%),尽管两组均未观察到GCT患者死亡(Albers et al,2008)。该项研究显示RPLND时腹膜后淋巴结组织学阴性患者的局部复发率为11%,远高于有经验的中心所有患者的局部复发率。这项试验的患者是在德国的61个不同的中心接受治疗,外科医师相对经验缺乏和单侧淋巴清扫可能是导致该不良结局的原因。选择RPLND的患者应该由经验丰富的外科医师进行完全的双侧标准的切除手术。否则,患者应该接受主动监测或初始化疗。
RPLND可以使60%~90%的p N1疾病患者和100%仅有畸胎瘤的患者治愈(无论淋巴结受累的程度如何)(Pizzocaro and Monfardini,1984;Williams et al,1987;Richie and Kantoff et al,1991;Rabbani et al,2001;Sheinfeld et al,2003;Stephenson et al,2005b)。p N2~3疾病患者复发的风险>50%(Vogelzang et al,1983;Williams et al,1987;Socinski et al,1988;Stephenson et al,2005b)。在2个周期的辅助化疗[最常见的是BEP×2或依托泊苷顺铂(EP)×2]中,复发率降至1%以下(Behnia et al,2000;Albers et al,2003;Kondagunta et al,2004)。对病理Ⅱ期病变患者进行RPLND后,一项随机临床试验对比研究了辅助化疗和进行观察的结果,显示化疗使复发风险明显降低(6%vs.49%),但整体存活率无差异(Williams et al,1987)。辅助化疗和观察是病理Ⅱ期患者可接受的治疗选择,应告知患者RPLND后复发的风险及这些措施潜在的益处和风险。
④初期化疗:与RPLND后给予病理Ⅱ期患者的辅助化疗不同,初期化疗是指睾丸切除术后给予临床Ⅰ期NSGCT的治疗。初始化疗的目标是使复发的风险最小化,并使患者避免RPLND和诱导化疗(针对监测复发的患者)。初始化疗的基本原理是基于RPLND后作为辅助治疗的两个周期化疗清除微小转移病灶的有效性及尽管进行了RPLND,仍有20%~25%的患者需要化疗(作为辅助治疗或用于治疗复发) (Donohue et al,1993;Hermans et al,2000;Nicolai et al,2004;Stephenson et al,2005a)。初始化疗为患者带来最大的无复发机会,并且可以在社区实施(Tandstad et al,2009,2010)。初始化疗的缺点如下:不能治疗腹膜后畸胎瘤,而且使患者有可能发生化疗耐药和(或)晚期复发(后面讨论);需要长期进行腹膜后CT监测;使所有患者都承受化疗和迟发性毒性作用的潜在风险(如心血管疾病和继发性恶性肿瘤)。两个周期化疗的迟发毒性风险尚不明确,似乎没有安全的下限。
在已发表的12篇文章对初期化疗进行了研究,其中大多数使用了BEP×2方案(表14-5)(Abratt et al,1994;Cullen et al,1996;Pont et al,1996;Ondrus et al,1998;Bohlen et al,1999;Amato et al,2004;Chevreau et al,2004;Oliver et al,2004;Dearnaley et al,2005;Albers et al,2008;Tandstad et al,2009,2010)。在具有淋巴血管浸润和(或)EC占主导的男性中,初始化疗可以将复发率从30%~60%降至2%~3%。其中8篇文章提到,平均随访5年的结果没有死于GCT的报道。在另4篇包括406例患者的研究中,观察到13例复发(3%),其中6例(46%)复发的患者死于生殖细胞瘤。虽然初期化疗与最低的复发风险相关,但这些复发不太适合于补救治疗,因为病变具有化学耐药性,特别是如果他们接受了标准剂量BEP以外的方案。相比之下,RPLND或监测后复发的化疗初治患者,几乎全部可通过化疗得到治愈。虽然经初始化疗的患者,肿瘤复发并不常见,但几乎全部复发都发生在腹膜后,这就要求在随访中使用腹部盆腔CT进行监测。许多欧洲机构更愿意采用BEP×2化疗,而不是RPLND,因为后者主要用于临床分期,而不是治疗的目的(Krege et al,2008a,2008b;Schmoll et al,2009b)。
表14-5 临床Ⅰ期非精原细胞瘤初次化疗系列研究
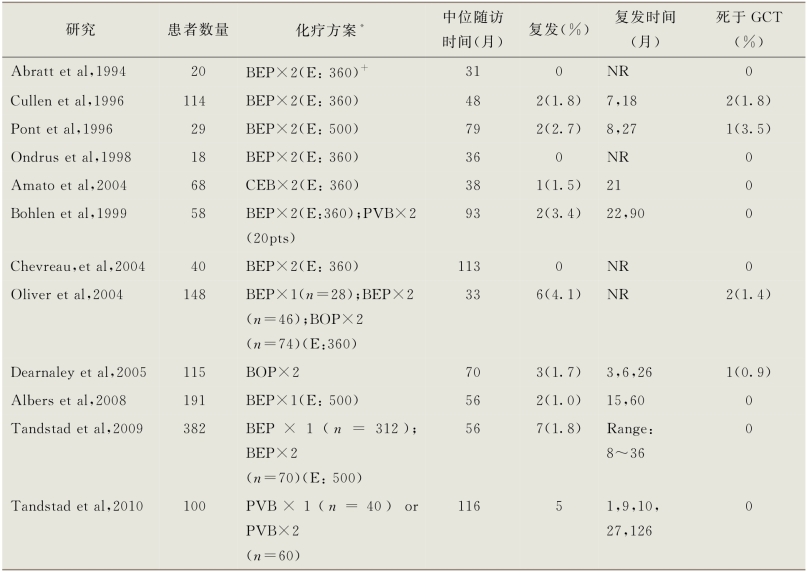
*化疗方案:BEP.博莱霉素-依托泊苷-顺铂;BOP.博来霉素-长春新碱-顺铂;CEB.卡铂-依托泊苷-博来霉素;PVB.顺铂,长春新碱,博来霉素
+E:360是指每周期360mg/m2的依托泊苷剂量;E:500是指每周期500mg/m2的依托泊苷剂量
NR.未报告;pts.患者
GCT.生殖细胞肿瘤
一项随机临床试验和一项基于人群的研究调查了BEP×1作为临床Ⅰ期NSGCT的初期化疗方案的随访结果(Albers et al,2008;Tandstad et al,2009)。在这两项中位随访时间不足5年的研究中,BEP×1化疗后复发的风险为1%~3%,肿瘤特异性生存率均接近100%。将来研究需要在随机试验中将BEP×1与BEP×2进行比较,以验证其安全性和有效性。
⑤临床Ⅰ期NSGCT的治疗选择:尚没有关于临床Ⅰ期NSGCT的标准治疗方法的随机对照试验。一项Ⅲ期随机临床试验比较了BEP×1与单侧改良RPLND(病理Ⅱ期患者应用BEP×2)(Albers et al,2008)。尽管应用BEP×1方案的患者复发风险显著降低[风险比(HR)0.13,95%置信区间为0.02~0.55],但两组均没有肿瘤特异性死亡。这项试验比较了临床Ⅰ期NSGCT的两种非标准治疗方法,故而受到批评(Sheinfeld and Motzer,2008)。
鉴于对患者进行主动监测、RPLND和初始化疗的良好长期生存率,推荐任何特定的治疗方案都是不恰当的,因为每种方法在治疗相关毒性、后续治疗的需求、化验和影像学监测的强度等方面都存在相对的优缺点。同时,患者的偏好可能会有所不同,也应予以考虑。临床Ⅰ期NSGCT的一些临床实践指南已经出版,通常建议对低危患者进行主动监测,对高危患者进行主动监测、RPLND或初始化疗(Albers et al,2005;Motzer et al,2006;Hotte et al,2008;Krege et al,2008a,2008b;Schmoll et al,2009b;Stephenson et al,2011)。Nguyen及其同事(2010)开发了一种决策分析模型,根据癌症预后,治疗相关毒性和患者对重要治疗后结局的偏好以确定临床Ⅰ期NSGCT的最佳治疗方案。当评估的复发风险在33%~37%时,主动监测与最高质量的调整生存率相关联。当复发风险>46%~54%时,积极治疗(RPLND或初期化疗)更有利。
(2)临床ⅠS期NSGCT:临床ⅠS期被定义为睾丸切除术后血清肿瘤标志物升高,但无临床或影像学转移性病变的证据。临床ⅠS期肿瘤患者进行初始RPLND的研究显示,37%~100%的患者因为腹膜后转移、血清肿瘤标志物持续升高或复发需要后续化疗(Davis et al,1994;Saxman et al,1996)。有共识认为,这些患者应该接受类似于临床ⅡC期和Ⅲ期患者的治疗,并接受诱导化疗。临床ⅠS期患者化疗后癌症特异性生存率超过90%(Culine et al,1996;International Germ Cell Consensus Classification,1997)。进行睾丸切除术后,血清肿瘤标志物水平略有升高和稳定,没有临床病变证据的患者,应谨慎解释,因为它们可能代表转移性NSGCT的假阳性结果。
(3)临床ⅡA期和ⅡB期NSGCT:临床ⅡA和ⅡB期NSGCT的最佳治疗方案是有争议的。RPLND(有或无辅助化疗)和诱导化疗(有或无化疗后RPLND)是可接受的治疗方案,生存率均超过95%。没有随机试验对这两个治疗方法进行比较。一项前瞻性、多中心、非随机的临床试验对进行RPLND+两个周期的辅助化疗与诱导化疗进行了对比。结果显示,两组在复发率(RPLND组为7%,化疗组为11%)或总生存率方面没有显著差异(Weissbach et al,2000)。对RPLND(病理Ⅱ期辅助两个周期的化疗)和诱导化疗的单中心非随机回顾性比较研究显示,诱导化疗的复发风险显著降低(98%vs.79%),但两种治疗方案的癌症特异性生存率均接近100%(100%vs.98%)。接受RPLND的患者接受较少的化疗周期(平均4.2 vs.1.4),其中有51%的患者避免了化疗(Stephenson et al,2007)。
支持临床ⅡA和ⅡB期NSGCT进行RPLND的观点如下:①13%~35%的患者淋巴结病理呈阴性并且可避免化疗(Pizzocaro et al,1987;Donohue et al,1995;Weissbach et al,2000;Stephenson et al,2007);②约30%的患者有腹膜后畸胎瘤,对化疗耐药(Foster et al,1996;Stephenson et al,2007);③伴或不伴辅助化疗的RPLND的长期癌症特异性生存率为98%~100%(Pizzocaro et al,1987;Donohue et al,1995;Weissbach et al,2000;Stephenson et al,2007);④10%~52%的患者避免了任何化疗(Pizzocaro et al,1987;Donohue et al,1995;Weissbach et al,2000;Stephenson et al,2007);⑤70%~90%的患者保留了射精功能(Richie and Kantoff,1991;Donohue et al,1995;Weissbach et al,2000)。RPLND的缺点如下:①48%或更多的患者需要额外的治疗;②13%~15%的患者在RPLND后持续存在病变并且需要全程诱导化疗;③可能无法在所有机构完成高质量RPLND(Weissbach et al,2000;Stephenson et al,2007)。
支持诱导化疗的观点如下:①60%~78%的患者可获得完全缓解,避免应用化疗后手术治疗;②可在社区机构进行治疗;③癌症特异性生存率为96%~100%(Peckham and Hendry,1985;Logothetis et al,1987;Socinski et al,1988;Ondrus et al,1992;Horwich et al,1994;Lerner et al,1995;Culine et al,1997;Debono et al,1997;Weissbach et al,2000;Stephenson et al,2007)。化疗的缺点如下:①所有患者都有接受长期化疗毒性的风险;②未接受化疗后RPLND的患者有化疗抵抗性GCT复发的风险。
鉴于临床ⅡA期NSGCT患者中有13%~35%是淋巴结病理阴性(假阳性CT结果),因此对于在分期腹部盆腔CT影像上显示不确定病变的患者,如果在其他方面存在转移性病变的风险较低,可以在最初进行密切观察,以澄清后续的治疗方案。临床ⅡA和ⅡB期NSGCT的治疗考虑因素包括隐匿性全身性病变、腹膜后畸胎瘤的风险,短期和长期治疗相关的并发症发生率及双重治疗的需求。最后一项考虑是最不重要的,但对这些患者的最佳治疗选择有强烈的影响。如前所述,由于转移性NSGCT经常作为化疗敏感性恶性GCT和化疗耐药性畸胎瘤存在,“治愈”通常需要化疗和手术相结合。
过去20年,在低分期NSGCT中应用初始RPLND的临床经验已经确定其是与全身复发相关的决定性因素。与临床ⅠS期NSGCT一样,睾丸切除术后出现AFP和hCG水平的升高与RPLND后全身复发风险增加相关。Rabbani及其同事(2001)报道,睾丸切除术后血清肿瘤标志物正常的45例患者中7例(16%)复发,而术后AFP和hCG水平升高的5例患者中有4例(80%)复发。Stephenson及其同事(2005)发现血清肿瘤标志物升高(HR=5.6,P<0.001)和腹膜后淋巴结病变>3cm(HR=12.3,P<0.001)是RPLND后全身复发的重要预测因子。有专家共识认为临床ⅡA和ⅡB期NSGCT患者,具有AFP或hCG水平升高或大体积的淋巴结(>3cm)应接受诱导化疗。
因为腹膜后畸胎瘤对化疗耐药,所以它的存在是任何转移性NSGCT单独使用化疗策略的限制。总体而言,大约20%的临床ⅡA和ⅡB期患者存在腹膜后畸胎瘤,而在原发性肿瘤中具有畸胎瘤成分的患者,发生腹膜后畸胎瘤的比例增为30%~35%(Donohue et al,1995;Foster et al,1996;Stephenson et al,2005)。残余微小畸胎瘤可能终身保持休眠状态并临床沉默。也可能表现出缓慢的生长,这可以应用CT影像进行监测,并可通过手术切除得以治愈。然而,畸胎瘤未切除的最严重后果是畸胎瘤综合征、恶变和晚期复发(尽管罕见)。对于那些具有腹膜后畸胎瘤风险,而全身其他部位病变风险较低的患者(血清肿瘤标志物正常,淋巴结增大<3cm),RPLND是首选的初始治疗方案。
(4)临床ⅡC和Ⅲ期NSGCT:以顺铂为基础的诱导化疗是用于治疗临床ⅡC和Ⅲ期NSGCT的初始方法。如前所述,诱导化疗也是睾丸切除术后伴有AFP和hCG升高的临床ⅠS期和临床ⅡA和ⅡB期肿瘤的优先治疗方案。具体的方案和周期数以IGCCCG风险分层为基础(见表14-2)(International Germ Cell Consensus Classification,1997)。
以顺铂为基础的化疗的发展代表了GCT治疗中最重要的进展。在确定顺铂之前,10%~20%的患者对化疗有完全反应,治愈率仅为5%~10%(Einhorn et al,1990)。目前,预计80%~90%的转移性GCT患者可以长期治愈。随机试验已经评估了各种不同药物组合的有效性和安全性,以确定基于IGCCCG风险的最佳方案(Debono et al,1997)。
最初的标志性研究是在印第安纳大学在20世纪70年代用顺铂-长春碱-博来霉素(PVB)×4进行的,报道74%的患者有完全反应,并且有70%以上的长期生存率(Beck et al,2005)。一项多中心随机试验将PVB×4与BEP×4进行了比较研究,证实依托泊苷可以治愈部分PVB化疗后复发的患者。两种方案的总生存期没有显著差异(2年生存率80%,P=0.11),但与BEP×4相关的神经肌肉毒性较低,随后被采纳为标准方案(Williams et al,1987)。
5.低危NSGCT的化疗
BEP×4成为进展性GCT的标准治疗方案后,随后的试验着重于降低具有低风险特征的患者的毒性,并改善中危和高危患者的预后。对于低危患者,两项随机试验显示,BEP×3并不逊于BEP×4(Einhorn et al,1989;Saxman et al,1998;de Wit et al,2001)。一项在美国纳入184例患者的研究显示,在最少1年的随访中,每组有92%的患者表现为持续无瘤生存,在随后的分析中报告随访10年时每组有4例死亡(Einhorn et al,1989;Saxman et al,1998)。欧洲一项国际性研究比较了BEP×3与BEP×4在800多例IGCCCG分类低危患者中应用的结果,显示2年无进展生存率(90%vs.89%)和总生存率(各组为97%)均相似(de Wit et al,2001)。作为这些研究的结果,BEP×3成为低风险GCT的标准治疗方案。
为了减少毒性,研究人员研究去除博来霉素和用卡铂替代顺铂的效果。所有的随机试验中,顺铂与卡铂治疗方案相比,顺铂效果更好(Bajorin et al,1993;Bokemeyer et al,1996;Horwich et al,1997,2000;Bokemeyer et al,2004)。在低风险患者中是否可以从基于顺铂的方案中去掉博来霉素的问题尚不明确,并且是进展性GCT治疗中少有的争议之一。去掉博来霉素的基本原理是基于肺部并发症(包括肺纤维化)和雷诺现象的风险。尽管在所有试验中均未显示出显著的生存率差别,但所有研究均显示含博来霉素方案具有优势倾向(Bosl et al,1988;Levi et al,1993)。EP×3不如BEP×3(Loehrer,1995)。一项欧洲随机试验比较了BEP×4与EP×4(具有降低剂量的依托泊苷)的完全缓解率,显示前者具有明显较高的完全缓解率(95%对87%,P=0.008),但总生存率没有差异(de Wit et al,1997)。最近,一项法国的随机试验比较了BEP×3与EP×4(使用常规剂量的依托泊苷)两种方案,结果显示两者之间在复发风险或生存率方面未能发现统计学差异(Culine et al,2007)。BEP×3和EP×4均被lGCCCG标准接受为进展性GCT及低风险特征患者的治疗方案,5年总生存率为91%~94%(International Germ Cell Consensus Classification,1997;van Dijk et al,2006)。
6.中危和高危NSGCT的化疗
自1987年以来,BEP×4一直是具有中危和高危进展性GCT患者的标准治疗方案,中危患者相应的5年生存率为79%,高危患者相应的5年生存率为48%(International Germ Cell Consensus Classification,1997)。已经有随机试验研究了使用依托泊苷-异环磷酰胺-顺铂(VIP×4)或长春碱-异环磷酰胺-顺铂(VeIP×4)的异环磷酰胺方案,并与BEP×4进行了比较(de Wit et al,1998;Nichols et al,1998;Hinton et al,2003)。一项美国多中心试验报告了近300例进展性GCT男性患者的结果,根据IGCCCG标准划分为低、中、高危的患者分别为13%、23%和64%(Nichols et al,1998;Hinton et al,2003)。BEP×4和VIP×4两方案相比较,其2年生存率分别为71%和74%;5年生存率分别为57%和62%。2年生存率和5年生存率均无显著差异(Nichols et al,1998)。美国研究结果出炉后,欧洲的研究提前结束了。然而,其纳入84例患者,且中位随访时间超过7年的研究结果显示,BEP×4组有2例死亡,VIP×4组有1例死亡,5年总生存率>80%(de Wit et al,1998)。在BEP×4和VIP×4试验中,BEP×4的死亡人数更多,但差异并不显著。由于VlP×4导致更高的血液系统和泌尿系统毒性,因此BEP×4仍然是中危和高危GCT患者的标准治疗方案。但是,这些试验表明异环磷酰胺替代博来霉素时可以获得类似的肿瘤治疗效果。对肺功能受损患者和可能进行广泛胸部手术切除化疗后残余病变的患者,VlP×4可替代BEP×4(Kesler et al,2008)。
对于预后不良的GCT患者,已有研究显示,可使用卡铂-依托泊苷为基础的高剂量化疗(HDCT)方案和自体干细胞支持(也称为干细胞救援)替代BEP×4方案。HDCT的基本原理是假设增加剂量可能会克服化疗抵抗性。研究最广泛的方案包括单独使用卡铂-依托泊苷或联合使用环磷酰胺,异环磷酰胺,紫杉醇或塞替派(Beyer et al,1996;Bokemeyer et al,2002a;Einhorn et al,2007;Kondagunta et al,2007;Lorch et al,2007;Kollmannsberger et al,2009)。由于顺铂的肾毒性和神经病变的剂量限制,在HDCT方案中可应用卡铂。一项随机试验将219例中危(21%)和高危(79%)GCT患者随机分配至BEP×4与BEP×2组,然后分别接受两个周期的高剂量卡铂-依托泊苷-环磷酰胺和自体干细胞支持治疗,结果显示其1年持续完全缓解率(48%vs.52%,P=0.5)与总体生存率方面没有统计学差异(Motzer et al,2007)。对于两组患者,2年生存率为83%,5年生存率为71%。然而,接受HDCT的患者的毒性作用更为严重。一项较小规模的随机试验也未能证实HDCT与作为预后差的转移性GCT患者一线治疗的标准剂量方案相比能够改善生存率(Droz et al,2007)。因此,BEP×4仍然是中危和高危患者的标准一线治疗方案。
尽管对于高危GCT患者的标准化疗在20多年中没有改变,但这些男性的预后似乎随着时间的推移有所改善。在最初的IGCCCG分析中,高危患者的5年总生存率为48%,而随后的多中心随机试验报告生存率为60%或更高(Hinton et al,2003;Droz et al,2007;Motzer et al,2007;Culine et al,2008)。一项包含10组研究,纳入1775例转移性NSGCT患者(包括456例高危患者)的Meta分析显示,高危患者的5年生存率约为71%(van Dijk et al,2006)。
7.NSGCT化疗后残留肿块的处理
为了评估对以顺铂为基础的一线化疗的反应,患者应接受血清肿瘤标志物和胸部、腹部和盆腔的影像学检查(包括化疗前存在的其他病变部位)。根据患者对化疗的反应,将患者分为以下几类:①完全缓解,定义为血清肿瘤标志物恢复正常和放射影像学检查病变消除(通常定义为残留肿块≤1cm);②部分缓解-标志物阴性,血清肿瘤标志物恢复正常,但放射影像学显示具有持续肿瘤病变;③部分缓解-标志物阳性;④疾病进展,5%~15%的患者属于3类和4类,通常采用二线(也称为补救)化疗进行治疗(Einhorn et al,1989;Mead et al,1992;de Wit et al,1997;Debono et al,1997)。有明确的共识认为残留肿块>1cm的患者应该接受化疗后手术治疗(Albers et al,2005;Motzer et al,2006;Krege et al,2008;Schmoll et al,2009b)。完全血清学和影像学反应的患者的处理是有争议的,一些指南主张密切观察;另一些指南认为如果化疗前的肿块大小>3cm,则建议化疗后手术治疗(Albers et al,2005;Motzer et al,2006;Krege et al,2008a;Schmoll et al,2009b)。
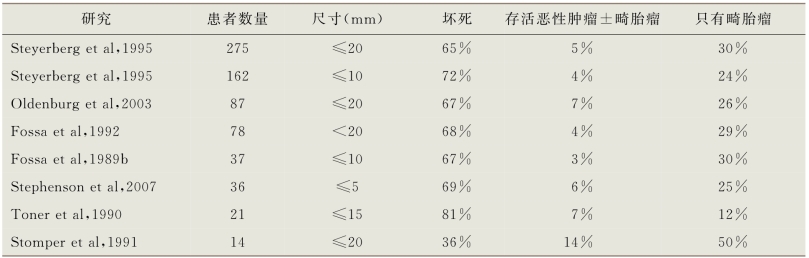
对于转移性NSGCT患者的残留肿块进行化疗后手术治疗的价值已经明确。其基本原理基于几个因素。多项大样本系列研究显示,患者在一线化疗后接受残留肿块的手术治疗,均一致性显示在50%或更多的切除标本中存在持续性的GCT成分。平均而言有40%、45%和15%的病例,其切除标本的组织学证实分别存在坏死、畸胎瘤和存活的恶性肿瘤(伴或不伴畸胎瘤)(表14-6)(Toner et al,1990;Gerl et al,1995;Steyerberget al,1995;de Wit et al,1997;Debono et al,1997;Hartmann et al,1997b;Sonneveld et al,1998;Stenning et al,1998;Steyerberg et al,1998;Hendry et al,2002;Albers et al,2004;Spiess et al,2006b;Carveret al,2007a)。完全切除其存活的恶性肿瘤的患者(有或没有进一步化疗),5年总生存率为45%~77%(Toner et al,1990;Fox et al,1993;Gerl et al,1995;Hartmann et al,1997;Donohue et al,1998;Stenning et al,1998;Fizazi et al,2001;Spiess et al,2006a;Carver et al,2007a;Fizazi et al,2008)。相反,如果不进行切除,残留的存活恶性肿瘤注定会复发,只有25%~35%的患者能获得二线化疗的持久缓解。
正如前面所讨论的,畸胎瘤对化疗有耐药性,并且存在于15%或更多的转移性NSGCT患者的转移部位。转移性畸胎瘤的存在限制了NSGCT单独使用化疗的任何策略,并且在大多数转移性GCT患者中需要整合化疗和化疗后手术治疗。未被切除的畸胎瘤可能表现出快速生长(畸胎瘤增长综合征),发生恶变或导致晚期复发,所有这些情况都可能具有致命性后果。转移性畸胎瘤的结局与手术切除的完整性有关。有研究报告显示,接受化疗后手术治疗其残余畸胎瘤的患者,长期存活率为75%~90%(Toner et al,1990;Hartmann et al,1997b;Sonneveld et al,1998;Stenning et al,1998;Carver et al,2007)。最后,在进行完整的双侧标准的RPLND后,<2%的患者发生腹膜后复发,基本上不再需要腹部和盆腔的影像学监测(Carver et al,2007)。
表14-6 化疗后残留肿块组织学
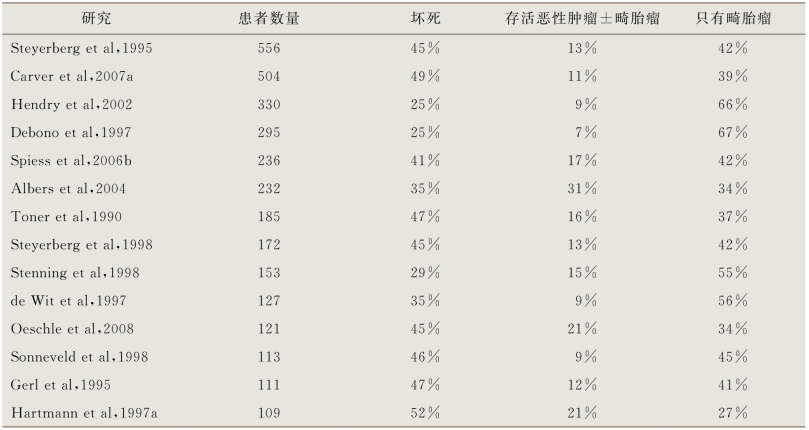
6%~8%的化疗后手术切除标本具有畸胎瘤恶变引起的非GCT恶性肿瘤的证据(Toner et al,1990;Little et al,1994;Carver et al,2007)。最常见的组织学是横纹肌肉瘤,并且大多数标本中存在i(12p)或12号染色体异常证明其起源于GCT(Motzer et al,1998)。与畸胎瘤一样,恶变患者的治疗结果与手术切除的彻底性与否有关,因为它们通常对GCT特异性化疗方案有耐药性。在完全切除的情况下,50%~66%的患者存活,而未完全切除的大多数患者经历肿瘤的快速发展而死于GCT(Little et al,1994;Comiter et al,1998;Motzer et al,1998;Lutke Holzik et al,2003;Carver et al,2007)。在选定的可检测病变仅限于一种组织学的患者中,对转化的组织学特异性化疗方案(如肉瘤特异性方案)进行了两个小型系列的研究。24例患者中有11例出现部分反应,其中6例存活(Donadio et al,2003;El Mesbahi et al,2007)。
在化疗后手术切除标本中仅有坏死的患者预后良好,多数研究报告其复发率为10%或更低(Toner et al,1990;Hartmann et al,1997b;Stenning et al,1998;Carver et al,2007a)。研究者试图寻找可预测高概率坏死的可靠因素,以避免在所有存在残留肿块的患者中应用化疗后手术的治疗方案。在一项早期的研究中,Donohue及其同事(1987)报道,15例在原发性肿瘤中不伴有畸胎瘤,而且化疗后残留肿块体积缩小90%或以上的患者,没有任何患者在化疗后手术治疗中发现存活的恶性肿瘤或畸胎瘤的证据。相反,在原发性肿瘤中存在畸胎瘤的9名患者,化疗后经历了相似的转移性肿瘤体积的减少,但化疗后手术治疗发现其中7例(78%)具有存活的恶性肿瘤和/或畸胎瘤的证据。原发性肿瘤中畸胎瘤的缺乏,化疗后腹膜后肿块减小的百分比和残留肿块的大小一直被确定为化疗后手术切除标本中坏死的预测因子(Toner et al,1990;Stomper et al,1991年;Fossa et al,1992;Steyerberg et al,1995,1998;Albers et al,2004)。然而,尽管使用这些因素和其他因素进行了统计学建模,研究报告显示坏死的假阴性率仍有20%(Steyerberg et al,1995,1998;Vergouwe et al,2001)。仅有腹膜后坏死的出现不足以准确预测具有残留肿块的患者是否可以安全地避免进行化疗后手术治疗。一个重要的概念是在原发性肿瘤中不存在畸胎瘤并不能排除其在腹膜后出现的可能(Toner et al,1990;Beck et al,2002)。研究人员还研究了FDG-PET在一线化疗后残余肿瘤组织学预测方面的应用。由于事实上畸胎瘤不具FDG亲和性,因此FDG-PET在预测NSGCT腹膜后组织学中的应用有限。一项对121例存在诱导化疗后残余肿块的患者的前瞻性研究显示,FDG-PET(56%)对存活恶性肿瘤或畸胎瘤的预测准确性并不优于CT(55%)或化疗后血清肿瘤标志物(56%)(Oechsle et al,2008)。FDG-PET对NSGCT患者和化疗后残留肿块的评估没有作用。
26%~62%的患者经历了一线化疗后血清学和放射影像学完全缓解(Einhorn et al,1989;Dearnaley et al,1991;Mead et al,1992;Debono et al,1997;Stenning et al,1998;Ehrlich et al,2010;Kollmannsberger et al,2010a)。这些患者的最佳管理是有争议的。支持对这些患者进行化疗后手术治疗的学者认为,残留肿块的大小(或化疗减少百分比)不能用于可靠地排除腹膜后残留病变的存在。许多研究表明,平均而言,具有20mm或更小残留肿块的患者分别有30%和6%的畸胎瘤和存活恶性肿瘤的发生率(表14-7)(Fossa et al,1989b;Toner et al,1990;Stomper et al,1991;Fossa et al,1992;Steyerberg et al,1995;Beck et al,2002;Oldenburg et al,2003;Stephenson et al,2007)。印第安纳大学对295例GCT患者进行诱导化疗后的分析发现,仅77例(26%)在化疗后有完全的血清学和放射影像学缓解;在观察等待策略下,92%的患者在5~10年时间内存活(Debono et al,1997)。这一结果突现了对具有残留肿块的患者进行化疗后手术治疗的价值。诱导化疗后血清学和放射影像学完全缓解的患者仅占整体患者的一小部分,这表明只有一部分患者选择观察等待是合理的。有两项研究证实残留肿块<1cm的患者在不进行化疗后手术治疗的情况下,所观察到的复发风险较低(4%~10%)并具有97%~100%的癌症特异性生存率(Ehrlich et al,2010;Kollmannsberger et al,2010a)。然而需要强调,这些患者的特性是大多数属于IGCCCG标准的低危患者,并且在原发性肿瘤中没有畸胎瘤。
表14-7 化疗后残留肿块(<20mm)的组织学
大约1/3的患者在多个解剖部位有残留肿块(腹膜后,胸腔和左锁骨上窝最为常见),这些患者应该切除所有可发现的残余肿物(Toner et al,1990;Gerl et al,1994;Hartmann et al,1997a;McGuire et al,2003)。尽管一些中心已经描述,可同时进行腹膜后、胸部或颈部淋巴结清扫术,但我们的做法是将膈下和膈上切除作为单独的手术进行。22%~46%的病例存在不同部位间病理组织学的差异(Toner,1990)。一般来说,腹膜后以外部位的化疗后手术标本的组织学更多出现坏死(60%),更少出现恶性肿瘤(10%)和畸胎瘤(30%)(Toner et al,1990;Gerl et al,1994;Hartmann et al,1997a;Steyerberg et al,1997)。除了残留肿块的大小和解剖部位的数目之外,化疗后RPLND标本中出现坏死对其他部位的坏死有很高的预测力(Steyerberg et al,1997)。在不同部位存在残留肿块,进行化疗后手术治疗的患者中,159例RPLND标本中存在坏死的患者,只有19例(12%)在其他部位有存活的恶性肿瘤或畸胎瘤(Tiffany et al,1986;Gerl et al,1994;Brenner et al,1996;Steyerberg et al,1997;Tognoni et al,1998;McGuire et al,2003)。RPLND应在化疗后进行其他部位手术治疗之前进行,因为腹膜后残留病变的可能性最高,而RPLND后病理学是其他部位病理学的强有力预测指标。如果RPLND标本是坏死组织,应该选择观察其他部位的小残留肿块。
如前所述,化疗后手术治疗标本中有存活恶性肿瘤的患者的5年生存率为45%~77%。在这种情况下术后化疗的作用是有争议的。Fox及其同事(1993)报道27例接受化疗后手术治疗,因为有存活的恶性肿瘤病变,然后再行辅助化疗的患者,有19例(70%)无复发,而7例采用观察等待,没有再行辅助化疗的患者全部复发。在一项对238例化疗后手术标本中有存活恶性肿瘤的患者的国际联合分析中,Fizazi及其同事(2001)将化疗前按照IGCCCG标准的中危和高危分类、不完全切除和化疗后手术标本中>10%的存活恶性肿瘤确定为重要的预后指标。患者具有0、1和2~3个危险因素的5年总生存率分别为100%、83%和51%。总的来说,术后化疗对5年无复发生存率有显著改善(73%vs.64%,P<0.001),但5年总生存率无差异(74%vs.70%,P<0.001)。在一项亚组分析中,具有一项危险因素的患者术后化疗的5年生存率提高(88%vs.56%,P=0.02),但有零项危险因素(100%生存率,化疗或无化疗)和2~3项危险因素(55%vs.60%)的患者术后化疗对其5年生存率没有影响。在一项确证性研究中,这个预后指数被证实对无复发和总生存率有效,并且在术后化疗和未化疗的患者中观察到这些终点没有显著差异(Fizazi et al,2008)。对于一线化疗后手术标本中具有存活恶性肿瘤的患者,残留肿块的完全切除是决定患者治疗结果的最关键因素。根据切除的完整性,lGCCCG风险分类,以及肿瘤活细胞的百分比来决定术后立即化疗和随访监测可能是合理的选择。关于这种情况的恰当的化疗方案以及应该应用的周期数尚没有共识。
在257例低危转移性NSGCT患者中,应用BEP×3与EP×4的随机试验研究强调了化疗后手术治疗的重要性(Culine et al,2007)。化疗后手术作为该试验的一部分,不受治疗方案的强行约束,仅仅52%患者接受了化疗后手术治疗,通常只涉及切除残留肿块。总的来说,20例复发患者中有14例(70%)和14例死于GCT的患者中有7例(50%)是未行化疗后手术治疗或者在不充分的RPLND后出现腹膜后复发。这些结果表明,适当的化疗和手术相结合可以预防很大比例的GCT死亡。
8.复发性NSGCT
复发性NSGCT的治疗取决于患者先前接受的治疗方法及对某些病例而言其复发的部位。从未接受过化疗的转移肿瘤患者的预后要比已接受化疗后发生转移肿瘤的患者的预后好得多。
(1)未接受化疗的NSGCT复发:未接受化疗的初治复发病例发生于接受监测或RPLND治疗的临床Ⅰ期NSGCT患者及单用RPLND治疗的临床ⅡA和ⅡB期NSGCT患者中。在监测过程中临床Ⅰ期NSGCT患者复发时的血清肿瘤标志物升高了60%~75%(Read et al,1992;Gels et al,1995;Sharir et al,1999;Alexandre et al,2001)。一般而言,这类患者接受诱导化疗,治疗的具体方案和持续时间根据lGCCCG的风险分类确定,且治愈率超过95%。临床Ⅰ期患者,监测中发现腹膜后非大块(<3cm)肿瘤复发和血清肿瘤标志物正常时,可通过诱导化疗或RPLND治疗(特别是如果原发肿瘤中存在畸胎瘤)(Stephenson et al,2007)。应用RPLND的合理性是避免化疗毒性或使其化疗不良反应最小化,RPLND无论是否联合应用辅助化疗,患者的长期治愈率均达到100%(Stephenson et al,2007)。在RPLND后复发的临床Ⅰ期、ⅡA和ⅡB患者通常累及肺或纵隔。几乎所有这些患者应用一线化疗可以治愈。在监测期间或RPLND后的大多数复发发生于起初的2年之内(Freedman et al,1987;Mc Leod et al,1991;Read et al,1992;Albers et al,1995;Gels et al,1995;Sogani et al,1998;Colls et al,1999;Sharir et al,1999;Francis et al,2000;Daugaard et al,2003;Stephenson et al,2005b;Albers et al,2008;Williams et al,2009b;Zuniga et al,2009;Kollmannsberger et al,2010a)。对于那些在睾丸切除术或RPLND术后2年以上复发且肿瘤标志物正常的少见患者,因为存在畸胎瘤的可能性较大,强烈建议应考虑进行活检或手术切除(Michael et al,2000;Oldenburg et al,2006)。虽然对于接受过化疗的复发患者,其复发时间是预后的一个重要决定因素,但未接受过化疗的患者超过2年复发与早期复发预后相似。
(2)NSGCT化疗后早期复发:先前接受了一线化疗后复发的男性应接受二线(挽救性)化疗。大多数复发出现于完成初始治疗的2年内,这些复发被归类为早期复发(de Wit et al,1998;Nichols et al,1998;Michael et al,2000;Culine et al,2007;Motzer et al,2007)。初次治疗后超过2年的复发被归类为晚期复发,并且在预后和治疗方面大不相同(稍后讨论)。那些表现为预后特别不好的早期复发患者是对一线治疗未能达到完全缓解或在完全缓解后6个月内复发的患者;这些患者常被称为不完全应答者(Fossa et al,1999c)。在一项来自38个中心,一线化疗后复发接受二线化疗的1984例患者的国际汇总分析中,中位无进展生存期为10个月,总生存期为41个月(Lorch et al,2010)。对诱导化疗的不完全应答(HR=1.4~1.9)、原发性纵隔NSGCT(HR=3.0)、非肺部的内脏转移(HR=1.3)、AFP(HR=1.3~2.0)和HCG(HR=1.5)升高与二线化疗后的进展风险增加相关联。
如前所述,依托泊苷和异环磷酰胺在一线化疗后复发的患者中已被证实有明显效果,这导致了VIP×4作为二线方案用于PVB×4后复发GCT的研究(Loehrer et al,1986;Einhorn,1990)。对于曾接受过BEP方案中依托泊苷治疗的患者,VeIP×4也作为二线治疗方案进行了研究(Loehrer et al,1998)。应用VIP×4和VeIP×4的研究,报道的长期缓解率为23%~35%,总生存率为32%~53%(McCaffrey et al,1997;Loehrer et al,1998;Pico et al,2005)。20世纪90年代早期紫杉醇研究所显示的对复发性GCT的疗效导致紫杉醇,异环磷酰胺和顺铂(TIP)方案的出现,并且报道的无复发生存率为36%~47%(Kondagunta et al,2005;Mardiak et al,2005;Mead et al,2005)。TlP×4,VlP×4和VelP×4方案从未在随机试验中进行过比较,都被认为是标准的二线治疗方案。
虽然HDCT作为二线治疗的作用尚存在争议,但是它作为复发GCT患者的二线(和三线)方案进行了研究。印第安纳大学进行了一项最大的单中心研究,包括一线(73%)或二线(27%)化疗后发生进展的184例转移性GCT患者。这些患者94%接受了两个或更多疗程的HDCT治疗(Einhorn et al,2007)。在4年的中位随访时间中,63%的患者持续无疾病生存,其中70%和45%的患者分别接受HDCT作为二线和三线治疗。一项国际配对分析比较了74例在单一机构接受了2~3个周期的VIP接着1个周期的使用卡铂-依托泊苷-异环磷酰胺的HDCT治疗的患者和119例在欧洲多个中心接受不同方案标准剂量二线化疗的患者的治疗结果,显示应用HDCT治疗的患者无事件生存率和总生存率提高了10%(Beyer et al,2002)。在一项随机对照试验中,将HDCT与标准剂量二线化疗相比较,共纳入43个机构的280例患者。标准剂量组患者接受VIP×4或VeIP×4,这取决于他们在一线治疗期间是否接受过依托泊苷。HDCT组患者接受VIP/VeIP×3,然后接受一个周期的高剂量卡铂-依托泊苷-环磷酰胺(Pico et al,2005)。在中位随访45个月后,完全和部分缓解率(两组均为56%)或3年无复发生存率(35%对42%,P=0.16),以及总生存率(两组53%)无统计学差异。
尽管在两项非随机研究中报道了良好的结果,但在随机试验中HDCT缺乏益处。这有几种可能的解释:首先,单组试验的结果可能受到病例组合差异的选择偏差的影响。此外,具有HDCT独特经验的机构取得的成果可能在其他机构无法复制。或者,在随机试验中采用的三个周期的标准剂量化疗和仅一个周期的HDCT治疗策略可能是次优的。印第安纳大学的治疗理念是尽快让患者接受HDCT,限制标准剂量化疗的周期,使患者能够更好地耐受HDCT,并给予2个周期HDCT。在随机试验中,只有73%被分配至HDCT组的患者能够接受HDCT,HDCT组因毒性作用造成的死亡是标准剂量组的2倍(7%vs.3%)。在印第安纳大学的病例系列中,94%的患者能够接受2个周期的HDCT,与治疗相关的死亡率为2.7%。尽管HDCT作为二线治疗可以治愈大量患者,但与三项随机试验(两项一线治疗和一项二线治疗)的标准剂量方案相比,未能证实存活率有所提高,不应被视为一种标准方法。目前,HDCT应仅在具有丰富经验的专业中心进行。
复发的高危患者(如不完全应答者)的治疗选择包括标准剂量、二线化疗或HDCT(如果在特定专业机构中进行)。对于一线化疗后6个月以上复发的患者,标准剂量二线化疗是首选方法。特别需要提及的是在一线化疗期间,血清肿瘤标志物下降或正常,伴有肿块增大(通常是囊性)的病例。应被认为患有畸胎瘤生长综合征。在这些罕见的病例中,暂时中断化疗,接受手术切除。完全手术切除对这些患者的长期预后是有利的(Logothetis et al,1982;Andre et al,2000;Spiess et al,2007)。
对于二线化疗后复发的患者,随后的选择是HDCT(如果以前未用)和包括吉西他滨、紫杉醇、奥沙利铂和伊立替康的各种药物组合的方案(Pectasides et al,2004;De Giorgi et al,2006;Bokemeyer et al,2008;Nicolai et al,2009;Oechsle et al,2011;Veenstra and Vaughn,2011)。
(3)挽救性化疗后残余肿瘤的处理:血清学完全缓解的二线化疗患者,如有残余肿块,应在挽救性化疗后进行手术切除。挽救性化疗后进行手术切除的患者与一线化疗后残留肿块的手术患者在几个方面有所不同。只有56%~72%的患者可以完全切除残余肿块(与此相比,一线治疗后的患者≥85%可以完全切除)(Fox et al,1993;Debono et al,1997;Hartmann et al,1997b;Stenning et al,1998;Eggener et al,2007a)。与一线化疗后的手术标本相比,挽救性化疗后手术标本的组织学特征是存活的恶性肿瘤检出率(53%)较高,坏死检出率(26%)和畸胎瘤检出率(21%)较低。患者的长期生存率也明显较差,在大多数病例系列中5年生存率为44%~61%(Fox et al,1993;Hartmann et al,1997b;Donohue et al,1998;Stenning et al,1998)。挽救性化疗后手术标本中有存活恶性肿瘤的患者预后特别差,且手术后化疗患者的生存率未得到改善。
(4)绝望手术:一线和二线化疗后大多数进展性疾病患者预后不良。然而,部分高度选择的患者仍可考虑行挽救性手术,这些患者血清肿瘤标志物升高,病变局限于单一部位(通常是腹膜后)并可被手术切除,我们通常称之为“绝望手术”。虽然已发表的研究仅限于小型单个机构病例系列,但47%~60%的患者术后血清肿瘤标志物恢复正常,无论是否术后化疗,术后患者长期生存率为33%~57%(Wood et al,1992;Murphy et al,1993;Eastham et al,1994;Albers et al,2000;Beck et al,2005)。
(5)NSGCT化疗后晚期复发:化疗后晚期复发定义为治疗后超过2年的复发。大约3%的NSGCT患者出现晚期复发(Ronnen et al,2005;Oldenburg et al,2006)。由于晚期复发罕见,应进行活检以确定诊断,特别是当血清AFP和hCG正常时。晚期复发可分为三种组织病理学类型:存活的恶性肿瘤(54%~88%,卵黄囊瘤最常见),畸胎瘤(12%~28%)和恶变(10%~20%,腺癌最常见的)(Baniel et al,1995;Gerl et al,1997;Michael et al,2000;George et al,2003;Sharp et al,2008)。
晚期复发的危险因素尚未明确,但既往有复发史和化疗后手术治疗标本中存在畸胎瘤(可能为切除不完全)与复发风险增加有关(Gerl et al,1997;Shahidi et al,2002)。大多数晚期复发的患者只存在一个部位的病变。大多数晚期复发发生于腹膜后(50%~72%),17%发生于肺,9%发生于纵隔,7%发生于颈部,4%发生于盆腔(Baniel et al,1995;Gerl et al,1997;George et al,2003;Dieckmann et al,2005;Oldenburg et al,2006;Sharp et al,2008)。在初始治疗阶段未能控制腹膜后病变是晚期复发的一个主要危险因素。血清AFP和hCG水平分别在50%和25%的晚期复发病例中升高(Oldenburg et al,2006)。血清肿瘤标志物升高作为晚期复发唯一表现的患者,应进行密切监测直至出现可检测的病变(George et al al,2003)。
直到最近,晚期复发仍比早期复发的预后更差,尽管目前数据显示这些患者可能有相似的治愈概率。一般来说,晚期复发对化疗有抵抗性,其治疗结果与能否通过彻底手术切除病变的能力有关(Gerl et al,1997;Shahidi et al,2002;George et al,2003;Dieckmann et al,2005;Oldenburg et al,2006;Sharp et al,2008)。
手术的重要性与畸胎瘤及其恶变本身对化疗不敏感,并且在先前的化疗(铂类抗性)中通常有存活的恶性肿瘤有关。在印第安纳大学接受化疗的32例晚期复发患者中,只有6例(19%)获得完全缓解。在最初接受手术治疗的49例晚期复发患者中,有45例(92%)无疾病生存[22例(45%)仅行手术治疗],29例(59%)完全缓解。总体而言,69例(85%)患者获得无瘤状态,38例(47%)患者在24.5个月的中位随访期内无瘤生存(George et al,2003)。依据Memorial Sloan-Kettering的经验,5年癌症特异性生存率为60%。在晚期复发时,完全手术切除(60%)与未完全切除(40%)的患者相比生存率显著改善(79%vs.36%,P<0.001)(Sharp et al,2008)。晚期复发的患者出现症状和多灶性病变与生存率低下相关联。在德国一项对72例NSGCT晚期复发患者的研究中,35例(49%)在最后一次随访时完全缓解,其中大部分人接受化疗和手术联合治疗(Dieckmann et al,2005)。对于晚期复发,最有利的化疗是TIP方案(Kondagunta et al,2005)。采取激进的手术方法切除所有病变既适合作为初始的治疗手段,也适用于对不可切除的病变在化疗后再实施。
9.精原细胞瘤
(1)临床Ⅰ期精原细胞瘤:大约80%的精原细胞瘤患者为临床Ⅰ期,并且是睾丸癌最常见的表现。在过去20年里,对于这一类患者的治疗与管理已经发生了很大的变化。主动监测、初始放疗及使用单剂卡铂的初始化疗是目前被认可的治疗选择。近几年关注的重点是降低治疗所带来的毒副作用。以铂类药物为基础的化疗和膈下放疗会导致后期心血管毒性及继发性恶性肿瘤的风险 (Zagars et al,2004;Travis et al,2005;van den Belt-Dusebout et al,2007;Beard et al,2013)。为了减少放射治疗的毒副作用,对如何最小化靶体积和靶剂量已经进行了研究。卡铂与顺铂相比具有更小的神经毒性、耳毒性及肾毒性,但其心血管系统毒性及继发性恶性肿瘤的风险在很大程度上尚不清楚。在许多情况下,这些方法的短期有效性和安全性已经通过随机试验得到验证。每种方式对癌症的长期控制接近100%。
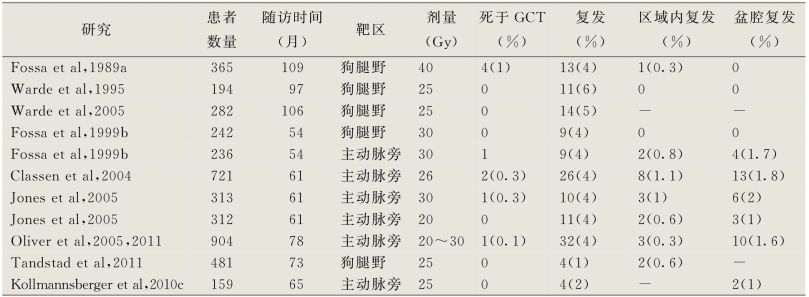
①初始放疗:过去40年里对于临床Ⅰ期精原细胞瘤最主要的治疗方法为针对腹膜后及同侧盆腔的一期放疗,该放疗范围被称为“狗腿野配置”。目前已知的针对临床Ⅰ期精原细胞瘤的放疗方案在表14-8中列出 (Fossa et al,1989a;Warde et al,1995;Fossa et al,1999b;Classen et al,2004;Jones et al,2005;Oliver et al,2005;Warde et al,2005;Tandstad et al,2011)。最佳放疗剂量尚未确定。大多数中心采用每日照射,经过10~15次照射,达到20~30Gy的剂量 (Fossa et al,1989a;Warde et al,1995;Fossa et al,1999b)。长期癌症特异性生存率接近100%,肿瘤无进展率为95%~97%(Fossa et al,1989a;Warde et al,1995;Fossa et al,1999b;Warde et al,2005;Kollmannsberger et al,2010c;Tandstad et al,2011)。“狗腿野”放疗之后照射区域内复发率<1%,可避免长期进行腹部盆腔CT监测。在既往未行腹股沟或阴囊手术的患者中腹股沟转移并不常见。最常见的复发部位是胸部及左锁骨上窝。几乎所有的复发均可以被一线化疗药物所治愈。小部分仅腹股沟复发的患者可行放疗或手术切除挽救。“狗腿野”范围放疗后的患者的监测内容主要包括定期的临床评估、胸部X线片及血清肿瘤标志物检查。
大多数患者会出现一些辅助化疗后的急性副作用,包括一过性的恶心、呕吐及腹泻,但是一般症状较轻且多有自限性。Ⅱ~Ⅳ度急性血液系统毒性发生于5%~15%的患者(Fossa et al,1999b)。中、重度迟发性胃肠道毒性(慢性便秘或消化道溃疡)据报道分别发生于5%及2%的患者。睾丸内的生精上皮对电离辐射十分敏感,尽管有防护罩,但散射剂量也会对对侧睾丸造成明显的影响。“狗腿野”范围放疗后,8%的患者会出现持续性少精子症(Fossa et al,1999b)。迟发性心脏毒性及继发性恶性肿瘤的问题与那些预期寿命较长的患者关系密切。精原细胞瘤放疗后25年继发性恶性肿瘤发生风险为18%,放疗后15年死于继发性恶性肿瘤的风险为2.64%,死亡率相较于非睾丸癌的患者增加了89%(Travis et al,2005;Beard et al,2013)。继发性白血病与放疗、化疗相关,而上消化道癌、膀胱癌及可能还有胰腺癌的发生率增加可能与放疗相关。
要点:NSGCT
•对于临床Ⅰ期的NSGCT,最佳的治疗方案还存在争议。主动监测,初始RPLND及BEP×2的初始化疗是广泛接受的治疗选择,并且其远期生存率接近100%。
•推荐基于是否存在淋巴血管浸润和胚胎瘤占主导的,与风险相适应的评估策略来指导治疗。主动监测适用于那些没有以上风险的患者,而积极治疗(RPLND或BEP×2)适用于存在淋巴血管浸润和胚胎瘤占主导的患者。一些中心采用了一种非临床风险适应方法,其中包括将主动监测作为所有患者的推荐方法。
•主动监测不适用于对影像学检测和随访临床评估依从性差的患者。对于在主动监测期间复发的患者,标准的治疗方案是基于IGCCCG风险评估的诱导化疗。但对于血清肿瘤标志物正常及非大块腹膜后腺瘤(<3cm),也可以通过RPLND 进行治疗。
•对于选择进行化疗的临床Ⅰ期NSGCT患者,BEP×2是标准方案。目前还未有充足的证据支持BEP×1作为一种可接受的选择方案。
•初始RPLND推荐采用完全的双侧标准的保留神经的淋巴清扫术。试图保持射精功能不应影响对肿瘤的疗效。RPLND应当由经验丰富的外科医师操作。
•病理分级Ⅱ级的患者初始RPLND后进行辅助化疗可以有效降低复发的风险,但是与采用随访观察并在复发时进行诱导化疗的策略相比,远期生存率没有明显差异。辅助化疗经常推荐用于具有广泛腹膜后转移(p N2-3)及术后预期其对肿瘤影像学监测及检验缺乏依从性的患者。
•对于临床ⅡA、ⅡB期NSGCT患者,诱导化疗和初始RPLND均是可被接受的治疗选择,并且远期治愈率达到95%甚至更高。对于那些在睾丸切除术后血清肿瘤标志物升高和(或)大块腹膜后淋巴结肿大(>3cm),可能具有隐匿性转移性病变的高危患者,更加提倡接受诱导化疗。
•对于临床ⅠS、ⅡC及Ⅲ期NSGCT患者的治疗是以顺铂为基础的诱导化疗。针对性化疗方案及化疗疗程数量根据IGCCCG风险标准来制定。对于低危患者,应该接受BEP×3或EP×4化疗,对于中危及高危的患者则应接受BEP×4化疗。采用与临床风险相适应的化疗方案和化疗后手术可使低危患者生存率达89%~94%,中危患者生存率达75%~83%,高危患者生存率达41%~71%。
•由于半数或超过半数的患者会存在残留癌(存活的恶性肿瘤或畸胎瘤),因此化疗后应对所有残留的包块进行切除。
•对经一线化疗后在残余包块内存在存活的恶性肿瘤的患者,是否要进行辅助化疗仍存在争议。
表14-8 临床Ⅰ期精原细胞瘤放疗系列研究
GCT.生殖细胞肿瘤
为了减少放疗的毒性作用,尝试减少靶体积和剂量并在随机试验中进行了评估。英国医学研究委员会(MRC)主持了一项关于在临床Ⅰ期精原细胞瘤患者中采用“狗腿野”放疗方案与主动脉旁放疗方案对比的随机临床试验(Fossa et al,1999b)。不进行同侧盆腔放射治疗的理由是,既往未经腹股沟或阴囊手术的患者盆腔淋巴结受累率低(1%~3%)。限制主动脉旁带的放射治疗可以降低继发性恶性肿瘤的风险,提高精子发生的恢复。主动脉旁放疗和“狗腿野”范围放疗的3年无复发生存率(96%vs.97%)和总生存率(99%vs.100%)相似,但接受主动脉旁放疗的患者精子发生的短期恢复有所提高(尽管3年时没有发现差异)。然而,主动脉旁放疗的盆腔复发率显著升高(2%vs.0,P=0.04)。这一细微但是明显的盆腔复发风险使得该放疗方案需要常规进行盆腔CT影像学监测随访,从而增加了患者费用与射线暴露(Brenner and Hall,2007)。
MRC与欧洲癌症研究与治疗组织(EORTC)也对临床Ⅰ期精原细胞瘤进行了一项采用20Gy或30Gy剂量进行主动脉旁放疗的临床随机试验(Jones et al,2005)。5年无复发生存率(96%vs.97%)与总生存率(99.6%vs.100%)十分接近,但是接受20Gy剂量的患者经历更少的急性胃肠道毒性,白细胞减少症及昏睡(在接受治疗的12周时两种剂量结果类似)。需要进一步随访以评估这些结果的持久性。
②主动监测:鉴于“狗腿野”放疗的迟发性毒性作用,睾丸切除术后80%~85%的治愈率及进展性精原细胞瘤以铂类为基础的化疗后超过90%的治愈率。多个中心对主动监测已经进行了评估,与NSGCT相比,临床Ⅰ期精原细胞瘤的血清肿瘤标志物对发现肿瘤复发效力有限,且由于10%~20%的复发常发生于诊断后的4年或更久,精原细胞瘤需要长期的CT影像学监测,因此其主动监测要复杂得多(Chung et al,2002)。
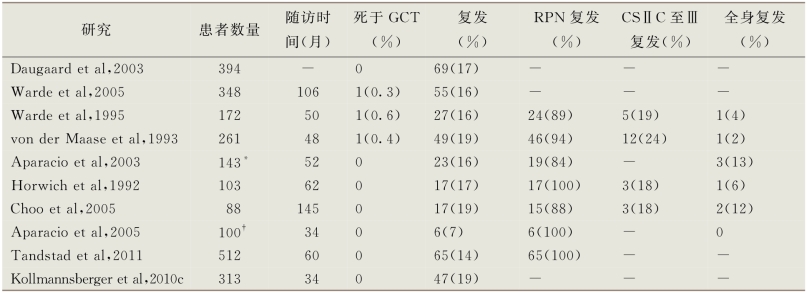
临床Ⅰ期精原细胞瘤最大的主动监测系列研究在表14-9中列出 (Horwich et al,1992;von der Maase et al,1993;Warde et al,1995;Aparicio et al,2003;Daugaard et al,2003;Aparicio et al,2005;Choo et al,2005;Warde et al,2005;Kollmannsberger et al,2010c;Tandstad et al,2011)。5年无复发生存率为80%~86%,肿瘤特异性生存率达到100%。在这些患者中,84%~100%的肿瘤复发位于腹膜后,而18%~24%的患者在复发时有巨大的腹膜后肿物和(或)远处转移(Horwich et al,1992;von der Maase et al,1993;Warde et al,1995;Aparicio et al,2003;Choo et al,2005)。“狗腿状”放疗被应用于73%~88%的复发患者,治愈率为70%~90%。几乎所有腹膜后以外部位复发的患者在使用一线化疗药物后可达到治愈。
表14-9 临床Ⅰ期精原细胞瘤监测系列研究
*有淋巴血管侵犯或临床分期≥T2的患者除外
†肿瘤体积>4cm或睾丸再次侵犯的患者除外
CS.临床分期;GCT.生殖细胞肿瘤;RPN.腹膜后
为了能在早期发现复发并予以治疗,主动监测的患者需通过临床评估、胸部X线片、血清肿瘤标志物及腹部盆腔CT检查进行随访。在发现疾病的第1~3年,随访监测计划为每2~4个月进行一次评估;在第4~7年,每半年进行一次评估;随后每年进行一次评估。CT影像学评估的必要频率尚未有定论;许多中心在发现疾病的第1~3年,每4~6个月进行一次CT影像检测;第4~7年,每6个月进行一次;随后每年进行一次。一项来自MRC的临床试验表明对于低危临床Ⅰ期NSGCT的患者发现疾病的2年内,CT影像学监测的次数可以在不影响生存率及治疗负担的前提下由5次减少到2次(Rustin et al,2007)。目前还不能确定这些研究结果能不能被同样安全地应用到精原细胞瘤中。与NSGCT相比,精原细胞瘤5年后复发率更高,因此长期随访是必需的(Chung et al,2002)。
为了甄别出更适合进行积极治疗的患者,研究人员已经在积极努力寻找和鉴定隐匿性转移的预测因素。在一项包括了3个自1980年开始的大型主动监测系列研究的汇总分析中,基于多因素分析的结果显示,肿瘤>4cm及睾丸网受累是复发的明确预测因子 (Warde et al,2002)。与NSGCT相比,淋巴血管浸润并非临床Ⅰ期精原细胞瘤复发的明确预测因子。存在0个、1个和2个危险因素的患者,其5年复发率分别为12%、16%和32%。在该人群中,21%的患者同时有睾丸网受累与肿瘤>4cm。即使对所有的“高危”患者进行初始放疗或卡铂治疗时,仍会使2/3的临床Ⅰ期精原细胞瘤患者(他们可以通过睾丸切除术治愈)经受不必要的治疗。然而这些危险因素仍缺乏前瞻性验证。
③单剂卡铂初期化疗:以单剂卡铂进行1~2个疗程的初始化疗作为可能减少初始放疗迟发性毒副作用的一种替代选择已经进行了研究。使用单药卡铂的根本原因是基于进展性精原细胞瘤患者对其反应的完全缓解率为65%~90%(Horwich et al,2000),且其相较于顺铂毒副作用较轻。Oliver及其同事 (1994) 首次阐述了在78例患者中使用1~2个疗程的卡铂,后续只发生了2例复发,且没有患者死亡。已发表的关于卡铂在临床Ⅰ期精原细胞瘤中应用的研究在表14-10中列出(Dieckmann et al,2000;Reiter et al,2001;Steiner et al,2002;Aparicio et al,2003,2005;Oliver et al,2005;Kollmannsberger et al,2010c;Aparicio et al,2011;Tandstad et al,2011)。在以上研究中未发现患者死于精原细胞瘤,且3~5年无复发率在91%~100%。
表14-10 临床Ⅰ期精原细胞瘤辅助化疗系列研究

*33%患者接受一个周期的卡铂化疗
GCT.生殖细胞瘤
MRC与EORTC在1477例临床Ⅰ期精原细胞瘤患者中进行了一项以1个疗程卡铂化疗与20~30Gy剂量的主动脉旁放疗进行对比的Ⅲ期临床试验(Oliver et al,2005,2011)。在中位随访时间超过6.5年的情况下,5年无复发生存率两者接近(94.7%vs.96%),唯一1例死亡病例出现在主动脉旁放疗组。在这项试验中,接受卡铂化疗的患者比接受放疗的患者更少发生嗜睡,恢复正常工作的时间也更短,Ⅲ、Ⅳ级急性血液系统毒性作用发生于4%的患者。卡铂化疗还可降低对侧睾丸继发性恶性肿瘤的发生率(0.3%vs.1.7%,P=0.03)。
对于单疗程卡铂化疗的担忧是剂量不足导致的复发率上升。在对不同的研究进行比较时,已经显示1个疗程比2个疗程卡铂化疗有更高的复发率。另外在MRC/EORTC的临床试验中还发现当患者接受的卡铂化疗剂量不足时,复发风险也会上升(Dieckmann et al,2000;Oliver et al,2008)。最佳的卡铂剂量通过公式计算得到,即7×[肾小球滤过率(ml/min)+25]mg(Calvert and Egorin,2002)。卡铂剂量不应该基于估算的GFR来确定。推荐根据放射性同位素肾扫描显像结果来确定1个疗程卡铂的剂量或行2个疗程的化疗。
鉴于临床Ⅰ期精原细胞瘤复发的总体风险较低,临床上尚缺乏识别高危复发人群的前瞻性有效标志物,以及放疗与卡铂化疗所带来的迟发性毒性作用,许多临床指南现在都推荐主动监测作为首选措施 (Krege et al,2008a,2008b;Schmoll et al,2009a)。主动监测能使80%~85%的患者避免治疗所带来的不良反应,并且“狗腿野”放疗可以有效挽救绝大多数发生复发的患者。然而,主动监测必须持续5年以上,同时频繁的CT影像学检查是必需的。对那些依从性差或不愿意接受主动监测的患者,则推荐进行初期放疗或1~2个疗程的卡铂化疗。
(2)临床ⅡA、ⅡB期精原细胞瘤:15%~20%的精原细胞瘤患者为临床Ⅱ期;这部分患者中有70%为ⅡA、ⅡB期。大多数中心使用25~30Gy剂量(包括5~10Gy受累范围的增加剂量)的“狗腿野”放疗。对ⅡA、ⅡB期患者应用更高剂量的放疗时,总体上具有良好的耐受性,文献报道8%~10%的患者发生Ⅲ、Ⅳ级胃肠道毒性作用(Classen et al,2003b)。对左侧锁骨上窝的预防性放疗只有少于3%的患者能够从中受益,所以不再在临床上应用(Zagars and Pollack,2001;Chung et al,2003)。临床ⅡA、ⅡB期精原细胞瘤长期无疾病生存率分别为92%~100%和87%~90%,而两者的原位复发率分别为0~2%和0~7%(Zagars and Pollack,2001;Classen et al,2003b;Chung et al,2004b)。一项研究显示,在应用30Gy剂量的“狗腿野”放射治疗后增加单剂卡铂化疗,可使复发率从30%降低到6%,尽管需要进一步的数据来评估这种方法的实用性(Patterson et al,2001)。一线化疗可以使几乎所有的复发病例治愈,疾病特异性生存率达到100%。在病变完全消除后,不必常规进行CT影像学监测。
使用一线方案(BEP×3或EP×4)的诱导化疗是“狗腿野”放射治疗的可接受替代方案。西班牙生殖细胞肿瘤研究小组报告了在72例临床ⅡA和ⅡB期精原细胞瘤患者中使用BEP×3或EP×4的情况(Garcia-del-Muro et al,2008)。总体上,83%接受治疗的患者达到了血清学与放射学上的完全缓解;仅有1例患者仍有>3cm的残余肿瘤,2例患者化疗后行残留包块手术切除,结果发现在切除组织中仅存在坏死。5年无复发生存率为90%,总生存率为90%~95%。SWENOTECA研究小组也报道临床ⅡA、ⅡB期精原细胞瘤患者,73例接受以顺铂为基础的化疗后无复发,而29例接受放疗的患者,3例(10%)发生复发。诱导化疗应作为有大块肿瘤(>3cm)和(或)存在腹膜后多发肿块患者的优先治疗选择,因其复发风险低于“狗腿状”范围放疗(Patterson et al,2001;Chung et al,2004b;Garcia-del-Muro et al,2008)。
(3)临床ⅡC、Ⅲ期精原细胞瘤:与NSGCT相同,临床ⅡC、Ⅲ期精原细胞瘤患者应当接受诱导化疗,剂量和疗程数需根据lGCCCG风险标准确定。对于晚期精原细胞瘤,90%的患者会被归为低危类别,需接受BEP×3或EP×4的化疗方案。影像学完全缓解的患者比例为70%~90%,5年总生存率为91%(Loehrer et al,1987;Mencel et al,1994;International Germ Cell Consensus Classification,1997;Gholam et al,2003)。仅有10%的晚期精原细胞瘤存在非肺部的脏器转移(在IGCCCG风险标准中被归为中危)。应用BEP×4进行化疗后,患者的5年总生存率为79%,5年无进展生存率为75%(International Germ Cell Consensus Classification,1997)。单剂卡铂与顺铂为基础的联合化疗相比,在治疗晚期精原细胞瘤时生存率较低(Bokemeyer et al,2004)。
化疗后残留包块的处理:在一线化疗药物治疗后,58%~80%的患者仍存在影像学可发现的残留包块(Motzer et al,1987;Puc et al,1996;Duchesne et al,1997;Fossa et al,1997;Herr et al,1997;Flechon et al,2002;De Santis et al,2004)。这些包块会在50%~60%的患者中自发性消除,这些包块消除的中位时间为13~18个月(Flechon et al,2002;De Santis et al,2004)。这些残留包块的组织学结果显示,90%的病例为坏死,10%的病例为存活的恶性肿瘤 (Puc et al,1996;Herr et al,1997;Ravi et al,1999;Flechon et al,2002;De Santis et al,2004)。精原细胞瘤的化疗后手术治疗在技术上是困难的(而且通常是不可行的),因为化疗后发生的结缔组织增生反应导致围术期手术并发症增加 (Mosharafa et al,2003)。只有58%~74%的精原细胞瘤患者化疗后残留包块可通过手术完全切除(相比之下,NSGCT一线化疗后手术完全切除率≥85%)(Puc et al,1996;Herr et al,1997;Ravi et al,1999;Flechon et al,2002;De Santis et al,2004)。畸胎瘤及其恶变与晚期精原细胞瘤关系不大。对于精原细胞瘤化疗后残留包块的处理与NSGCT相比差别很大。
研究人员已经致力于寻找和明确与存在存活的恶性肿瘤高风险相关的因素,从而合理地界定化疗后手术的必要性。化疗后放疗在残留包块的治疗中没有作用(Duchesne et al,1997)。残留包块的大小是存活的恶性肿瘤的重要预测因子;27%~38%单个>3cm的残留包块含有存活的恶性肿瘤组织,当肿物<3cm时这一比例为0~4%(Puc et al,1996;Herr et al,1997;Flechon et al,2002;De Santis et al,2004)。FDG-PET已被发现是CT影像学的一个有用的辅助手段,可选择性用于需要进行化疗后手术的患者 (De Santis et al,2004)。对于>3cm的肿块,FDG-PET阳性扫描的特异性和敏感性分别为100%和80%。离散性残留包块>3cm的患者应进一步应用FDGPET进行评估,PET阳性的患者应进行化疗后手术,PET阴性的>3cm及<3cm的残留包块,都应进行观察随访。如果患者在完成化疗后太早进行扫描,炎症和残留的不能生存的恶性肿瘤可能会导致假阳性的PET结果。FDG-PET应延迟至化疗结束后至少4周进行。
(4)复发的精原细胞瘤
①未接受化疗的初治患者的精原细胞瘤复发:未接受化疗的初治患者的精原细胞瘤复发发生于进行主动监测的临床Ⅰ期精原细胞瘤及接受初期放疗的临床Ⅰ、ⅡB期精原细胞瘤的患者。对于前者,有研究报道73%~88%的患者接受了“狗腿野”放疗,治愈率为70%~90%。有巨大腹膜后肿物(>3cm)及全身性复发的患者需接受一线化疗,挽救率接近100%。一线化疗几乎能治愈所有初期放疗后腹膜外复发的患者。接受单剂卡铂化疗后复发的患者应当被视为化疗初治患者,并应行以顺铂为基础的一线化疗。
②化疗后早期复发的精原细胞瘤:在诱导化疗后有15%~20%晚期精原细胞瘤患者会出现复发,其中包括10%在最初对化疗呈完全缓解的患者(Loehrer et al,1987;Mencel et al,1994;International Germ Cell Consensus Classification,1997)。总体上,对一线化疗反应不完全的患者或在初次化疗后有明显临床反应随后又复发的患者预后会较差,长期生存率为25%~50%(Miller et al,1997;Vuky et al,2002;Gholam et al,2003)。由于需要进行二线化疗的精原细胞瘤患者数量较小,因此限制了对于独特治疗方案的评估,复发的患者所接受的化疗方案大多数是基于NSGCT复发而开发的。在2个小样本研究中,作为二线化疗方案的VeIP×4方案对36例复发的精原细胞瘤患者的治疗效果进行了评估,30例患者(83%)获得了完全缓解(有或没有化疗后手术切除),21位患者(53%)在长达72~84个月的平均随访时间内无复发(Miller et al,1997;Vuky et al,2002)。Vuky及其同事(2002)评估了12例晚期精原细胞瘤且进行一线化疗后不完全缓解的患者,使用高剂量化疗的效果,其中6位患者(50%)达到了完全缓解并且无复发。对于一线化疗后复发的晚期精原细胞瘤患者需要考虑复发灶为畸胎瘤的可能性。若患者的血清肿瘤标志物正常,在开始二线化疗前应当进行组织病理活检。
③化疗后晚期复发的精原细胞瘤:在大多数已公开发表的系列研究中,单纯精原细胞瘤占晚期复发事件的不到8%(Baniel et al,1995;George et al,2003;Ronnen et al,2005;Sharp et al,2008)。但是Dieckmann及其同事(2005)报道了122例晚期复发的患者,其中50例(41%)在诊断时为单纯精原细胞瘤。这些患者中仅6例(12%)之前接受过一线化疗,大多数患者在诊断为精原细胞瘤时接受的是单剂卡铂化疗或放疗。88%的患者获得肿瘤的长期控制。精原细胞瘤的晚期复发可能有良好的预后,尤其是对那些先前未接受顺铂化疗的患者。
10.脑部转移
1%的转移性GCT患者在开始化疗前检测到在脑部存在转移灶,0.4%~3%的患者是在一线化疗后发生脑部转移(Raina et al,1993;International Germ Cell Consensus Classification,1997;Fossa et al,1999a)。脑部转移常常和绒毛膜癌相关,而且所有血清hCG大幅升高的患者都应当怀疑其脑部转移的可能性(Fossa et al,1999a;Kollmannsberger et al,2000;Salvati et al,2006;Gremmer et al,2008;Nonomura et al,2009)。绒毛膜癌血管丰富且在化疗期间容易出血,文献报道由于颅内出血而导致的死亡率在4%~10%(Kollmannsberger et al,2000;Nonomura et al,2009)。这一风险在患者的治疗中需要被重视并应对神经系统的相关改变进行快速准确的评估。
要点:精原细胞瘤
•对于临床Ⅰ期精原细胞瘤,最佳的治疗方案还存在争议。主动监测,初期放疗(20~30Gy,主动脉旁区域,包括或不包括同侧盆腔),1~2个疗程初始卡铂化疗是广泛接受的治疗选择,并且每种治疗方案的远期生存率接近100%。
•临床Ⅰ期精原细胞瘤隐匿性转移的预后因素的研究尚没有NSGCT那么完善,考虑到总体较低的隐匿性复发风险(15%~20%),基于原发性肿瘤的组织病理学难以明确高危人群及初始放疗的潜在毒性作用,主动监测被推荐作为临床Ⅰ期精原细胞瘤的治疗方法。
•主动监测不适用于难以定期进行影像学及临床评估随访的依从性差的患者。对于在主动监测期间复发的患者,标准的治疗方案是“狗腿野”放疗(25~30Gy),对于具有巨大腹膜后淋巴结肿大或远处转移的患者,应当接受与IGCCCG风险标准相适应的一线化疗。
•初期放疗与单剂卡铂初期化疗在治愈率与生存率上结果接近。接受主动脉旁放疗及卡铂化疗的患者需要在治疗后定期进行CT影像学随访监测是否复发;接受“狗腿野”放疗的患者则不需要。
•“狗腿野”放疗(25~30Gy)与一线化疗(BEP×3或EP×4)是临床ⅡA、ⅡB期精原细胞瘤和非大块腹膜后淋巴结转移(<3cm)患者的治疗选择。一线化疗(BEP×3或EP×4)被推荐作为具有大块腹膜后淋巴结转移(>3cm)和/或多发腹膜后转移的治疗方法。
•临床ⅡC及Ⅲ期精原细胞瘤患者的一线治疗方法是以顺铂为基础的化疗。具体的化疗方案及化疗周期数根据IGCCCG风险标准来制定。对于低危患者,应给予BEP×3或EP×4方案,对于中危患者则应给予BEP×4方案治疗。
•一线化疗后存在散在且>3cm的残留包块应采用FDG-PET进行更深入的评估。对于FDG-PET阳性的残留包块,需行化疗后手术切除。若残留包块FDG-PET阴性或<3cm则可在化疗后安全地观察随访。
存在脑转移的转移性NSGCT患者与精原细胞瘤患者的5年总生存率分别为33%和57%(International Germ Cell Consensus Classification,1997)。化疗后完全缓解,然后发生脑转移复发的患者预后较诊断时就存在脑部病灶的患者更差,孤立性脑转移的患者与脑转移伴其他部位转移的患者总生存率分别为39%~44%与2%~26%(Fossa et al,1999a;Kollmannsberger et al,2000;Hartmann et al,2003;Salvati et al,2006;Gremmer et al,2008;Nonomura et al,2009)。在对伴脑转移的生殖细胞肿瘤患者的病例研究及汇总分析中已经报道了很多不同的治疗策略的结果,但是目前尚没有随机临床研究得出的明确最佳方案(Spears et al,1992;Fossa et al,1999a;Kollmannsberger et al,2000;Hartmann et al,2003;Salvati et al,2006;Gremmer et al,2008;Nonomura et al,2009)。治疗策略包括化疗、手术切除、全颅放疗及立体定位放射外科手术,大多数患者采用多模式治疗。在诊断时就伴有脑转移的患者应该接受BEP×4化疗,随后进行残留包块切除术。放疗在这种情况下的作用尚未明确(Fossa et al,1999a;Kollmannsberger et al,2000;Hartmann et al,2003)。在我们的医疗机构,放疗仅被考虑用于那些具有不能切除的残余病灶,而且鉴于辐射引起的神经毒性而不能接受立体定向放射外科治疗的患者(Doyle and Einhorn,2008)。在一线化疗后脑部复发的患者应接受二线化疗药物治疗,后续再进行手术切除或放疗(Fossa et al,1999a;Hartmann et al,2003)。若患者在脑部及其他部位同时发生复发,预后会非常差,尤其在非初次复发时。
要点:脑部转移•脑部转移和绒毛膜癌相关,而且所有血清hCG大幅升高的患者都应当怀疑其脑部转移的可能性。绒毛膜癌血管丰富且在化疗期间容易出血,造成颅内出血。
