关于针刺效果个体差异的问题
实验证明,施加同样的针刺手法或电针参数,有的动物或人体痛阈可以升高1倍以上,有的升高不到50%。这种个体差异是可以重复出现的,说明不同的个体其体质有所不同。但是这“体质”的不同,具体表现在何处?值得探讨。
假定针刺引起镇痛作用主要是由于引起中枢阿片肽的分泌,那么如果体内阿片肽含量不足,针刺效果肯定不会理想。
另一方面,体内有正面力量,往往就有反面力量来对抗,两者保持一个相对平衡。例如体内有交感神经系统,就有副交感神经系统作为对立面来保持平衡。脑内既然有“阿片肽”,发挥镇痛作用,是否会有“抗阿片肽”来制衡呢?为此我们专挑选针刺镇痛无效的动物,观察其脑内是否有某种“抗阿片物质”产生?在研究过程中我们发现了一个现象:正如注射吗啡过于频繁时其镇痛效果会逐渐减弱(发生吗啡耐受)一样,原来电针有效(镇痛)的动物,如果连续不断地给以电针,其镇痛效果也会逐渐减弱,我们将此现象命名为“电针耐受”。并设想其可能的机制是:由于多次电针引起阿片肽分泌太多,导致其对立面“抗阿片肽”的生成,发挥制衡作用,虽然当时对于设想中的“抗阿片肽”具体特征并无认识。
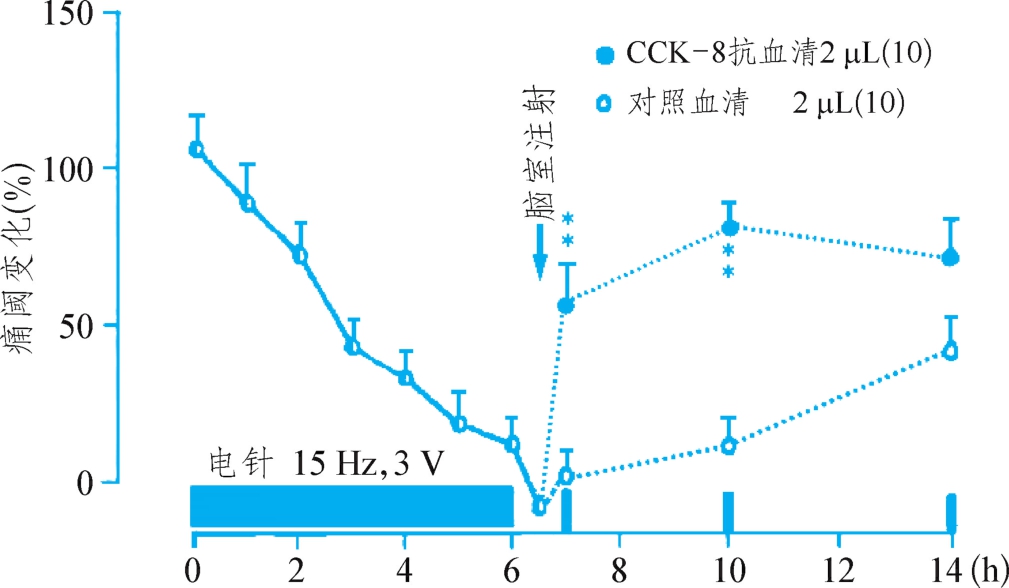
图1-2-5 电针耐受的发生及其被CCK抗体逆转的过程
为了验证上述设想,我们取针刺镇痛无效的大鼠,和多次电针引起“耐受”的大鼠,取其大脑制成匀浆,通过分子筛分离各种组分,检测是否有抗阿片物质。发现确实有一种分子量1000左右的成分,在生物检测中具有非常明显的对抗阿片作用,经过多方论证,认定其为8个氨基酸组成的小肽“八肽胆囊收缩素”(CCK-8)。在此基础上进行了下列实验:给大鼠15 Hz电针刺激,连续6个小时,测定大鼠的痛阈,发现电针初期出现的显著的镇痛效果随着刺激时间延长而逐渐降低,最终完全消失。与此同时,脑内CCK-8的含量则与时俱增。此时向大鼠脑室注射CCK-8的抗体,将脑内CCK-8的作用完全取消,则原已消失的镇痛效果重新出现,而注射对照血清则无此效果(图1-2-5)。有意思的是,注射对照血清虽然没有即时的翻转作用,但经过8个小时后,用短时程的电针刺激加以检验,电针镇痛作用又逐渐恢复。说明CCK引起的电针耐受的出现也是一个可逆的过程。
持续6个小时的电针刺激,导致大鼠镇痛效果逐渐减弱,发生“耐受”现象。此时脑室注射CCK-8的抗血清(CCK-8 AS),抵消了脑内CCK-8的抗阿片效应,则电针镇痛作用重新出现。注射对照(正常动物)血清则无效。说明长时间电针导致脑内CCK-8大量分泌,是电针耐受的重要原因。
可以将阿片肽的镇痛作用与CCK-8的抗阿片作用视为中枢神经系统调控个体痛觉敏感性的两条杠杆。阿片肽可以降低痛敏感性,而CCK-8(通过抵消阿片肽的作用)提高了痛敏感性。两种力量保持着一个动态平衡。降低痛敏感性的力量除了阿片肽,还有其他神经递质,例如5-羟色胺(5-HT)、去甲肾上腺素(NA,NE)等;提高痛敏感性的力量也不仅是CCK-8,还有其他抗阿片物质,如痛敏素(nociceptin)、血管紧张素Ⅱ(AgⅡ)等。对每一个个体来说,这些复杂因素的组合使个体痛敏感性的水平保持于一个相对稳定的“常态”。
当采用不同频率的电针对患者进行治疗时,对于每一条杠杆的撬动力实际上并不是均一的,可以随着患者当时精神和身体状态而不同。这就不难理解,针刺或电针的疗效会因人而异,因时而异。人体如此,动物实验也不例外。实验过程中除了严格控制动物种系、年龄、性别等条件以外,有人在做正式动物实验前,先给动物进行一轮试验性电针,观察是否有镇痛效果。如见到电针完全无效的个体就将其排除在外,专选电针有效的动物分析其作用机制,在这种特殊安排下,实验结果的波动性大大缩小,也不失为是一种可供选择的方法。临床上有各种可供选择的疗法,要根据患者具体情况,顺势而行,为每一患者找到其最佳选择。例如遇到一位脑内CCK功能低下的患者,使用电针镇痛,如同“四两拨千斤”,少用麻醉性镇痛药,效果出色,得心应手;如果面对一位脑内CCK功能特别旺盛的患者,就不应该选用针刺镇痛疗法。这是医者的最高境界,这也可能是“辨证施治”的机制之一。随着各种无创检测方法的不断出现,上述前景可能会梦想成真。
