砷剂和ATRA协同靶向治疗APL的作用机制
自20世纪80年代,上海血液学研究所应用ATRA诱导分化治疗APL取得成功,带动了全球范围对该疾病模型的机制性研究。90年代以来,通过对APL致病基因的克隆、表征和功能研究,对APL分子发病原理的认识有了重大突破,推动了新型白血病治疗学的研究进展。陈赛娟、陈竺研究团队继克隆了PML-RARα、PLZF-RARα等融合基因之后,又对这些基因编码的融合蛋白展开了较系统的结构功能研究。发现ATRA作为维甲酸受体的天然配体之一,不仅可结合于野生型RARα,也可以类似的亲和力结合于PML-RARα、PLZF-RARα融合蛋白。另一方面,三氧化二砷很可能作用于融合蛋白的PML部分。有意义的是,虽然两药在分子水平的作用机制上有明显差异,但二者均可诱导PML-RARα融合蛋白调变或降解。因此,该研究团队提出了PML-RARα可能是两种有效药物直接作用靶点并由此产生协同治疗作用的假设,围绕该核心科学问题进行了分子、细胞和整体水平的系统研究。
于90年代中期,陈赛娟、陈竺研究团队应用ATRA处理APL细胞株(NB4细胞)差异显示多聚酶链反应(PCR)方法,分离和克隆了APL细胞分化过程中受ATRA作用调控的一系列新基因,并将其命名为RA诱导基因(retinoicacid-inducedgene,RIG),包括RIG-G、RIG-E、RIG-I和RIG-K等。对这些基因编码蛋白的结构功能分析表明,它们均为参与造血干、祖细胞分化调控的关键因子。例如:RIGG是介导干扰素抗增殖作用的一个重要信号分子,通过提高细胞内周期抑制蛋白p27和p21的水平来抑制细胞生长;RIG-I与B淋巴细胞正常发育及分泌免疫球蛋白等生理功能有重要关联,也是髓系细胞增殖的一个负性调控因子,在无外源病毒RNA刺激条件下,RIG-I能直接与Src结合,干预Src对AKT的活化效应,通过抑制AKT-m TOR信号途径发挥抗白血病作用;RIG-K为永久性红细胞系列生成和原红细胞岛形成、特别是胎肝巨噬细胞的正常功能所必须,RIG-K还参与星极微管的稳定性和纺锤体的排列,从而影响细胞的有丝分裂。RIG系列基因及其蛋白产物功能的探索,丰富了对ATRA诱导分化治疗APL机制的认识。
2000年以来,上海血液学研究所研究团队应用ChIP-on-Chip技术和基因芯片技术,进一步从基因组水平展开了对PML-RARα异常转录因子靶基因的全局性研究,发现近3000个PML-RARα靶序列,其中超过60%包含典型的PU.1位点,这些PU.1位点中约84%在邻近区域具有一个或多个RARE半位点(即只含DR2或DR5两个重复基序中的一个,称为RAREh)。PU.1是正常髓系造血分化过程中的重要转录因子,通过功能性分析证实PML-RARα在基因组水平抑制了PU.1调控的靶基因,而ATRA可逆转这种抑制作用。该研究提出了一个全新的APL发病和ATRA治疗作用的模式(图1-8-1)。
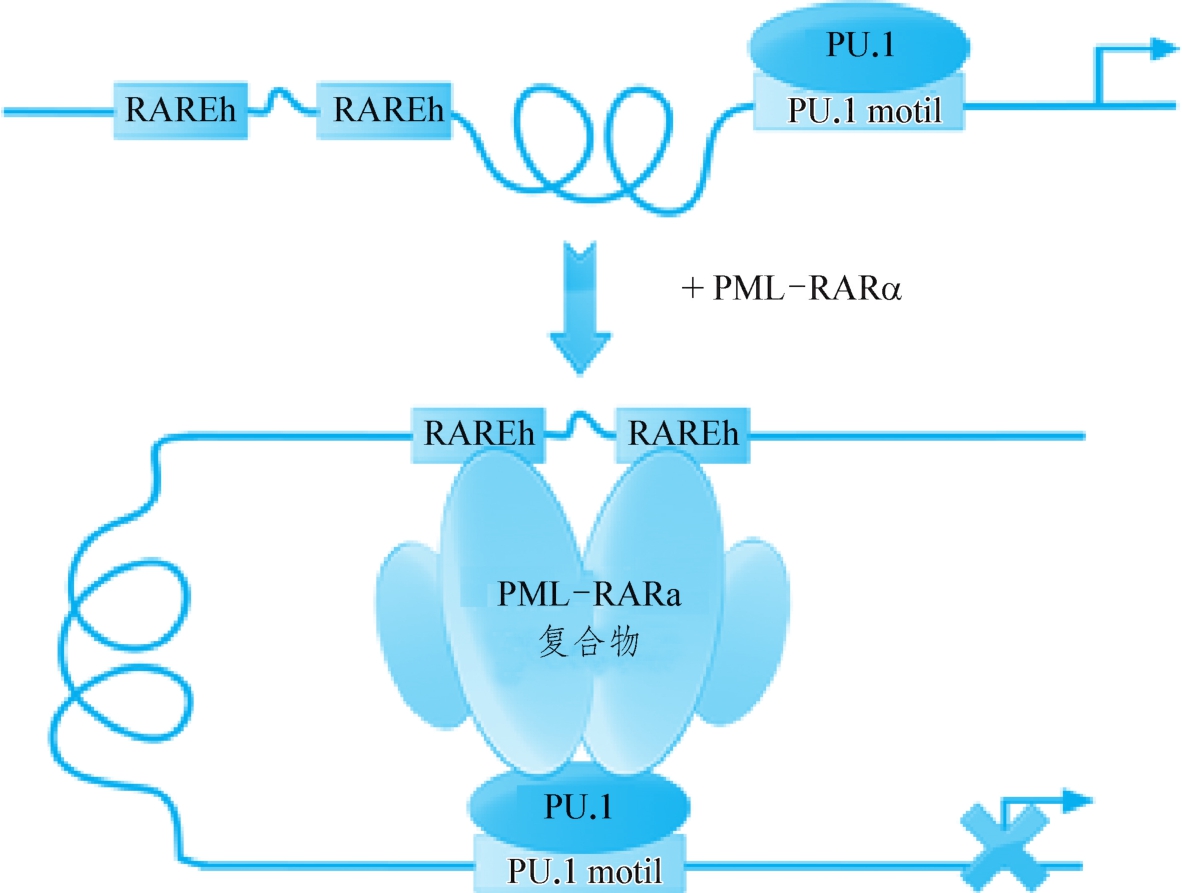
图1-8-1 PML-RARα干扰PU.1的转录调节功能导致APL发生的分子机制示意图
几乎与上述研究同步开展的,是对PML-RARα融合蛋白累及的PML蛋白结构、功能的解析。已知PML的RBCC区域包含1个RING结构域和两个B盒基序及1个螺旋环螺旋结构域,而RING结构域及两个B盒基序有数个富含半胱氨酸的锌指(ZFS),能够结合金属离子(生理条件下结合锌离子)。PML的显著特征是在核内作为支架蛋白与其他蛋白质形成NB,参与基因转录调节、细胞凋亡、生长抑制等多种重要功能。在APL细胞中,由于PML-RARα与PML形成复合物,破坏了NB的正常结构,代之以大量分散、弥散的点状结构。当用砷剂处理APL细胞时,可以恢复PML-NB的形成,提示砷剂有可能通过重构PML-NB的结构而恢复PML-NB的生长抑制功能和对凋亡的敏感性。
上海血液学研究所的研究证实:三氧化二砷可以诱导野生型PML及融合蛋白PML-RARα降解,但对于野生型RARα没有促进降解的作用,提示三氧化二砷有可能靶向作用于PML-RARα的PML部分。然而,要证明砷剂在APL细胞中能够选择性地作用于融合蛋白并阐明其结合部位并不容易。陈竺、陈赛娟团队首先用自制的生物素标记有机砷发现其与PML和PML-RARα蛋白结合,继而又发现荧光标记的有机砷可在APL细胞中结合PML-RARα。采用缺失突变的PML构建,证明RING结构域和第二个B盒基序是砷的结合部位。进一步与合作者应用蛋白质生化和质谱、近边结构X线吸收(XANES)及X线延伸吸收精细结构(EXAFS)等分析发现,砷剂直接与PML的RBCC区域中C3HC4锌指结构中的半胱氨酸巯基结合,诱导蛋白质发生构象变化和多聚化,并促进其与SUMO连接酶UBC9之间的相互作用增强,使PML和PML-RARα中的PML部分更容易被SUMO修饰,继而发生泛素化修饰而被蛋白酶体降解(图1-8-2)。该工作于2010年发表于Science之后,陈竺、陈赛娟团队的合作者法国乌格斯·德·特(Hugues de Thé)团队通过体外实验发现砷剂直接结合到PML蛋白上第二个B盒基序的C212/C213部位。此外,砷剂还可诱导活性氧的产生,形成分子间二硫化物。PML或PML-RARα通过二硫化物连接的多聚物,与核基质相互作用,形成PML-NB。这些研究成果揭示了PML-RARα中的PML部分的确是砷剂治疗APL的直接作用靶点,阐明了砷剂治疗APL的分子机制。2011年,两个团队合作在Nat Rev Cancer发表文章,对上述工作进行了总结。
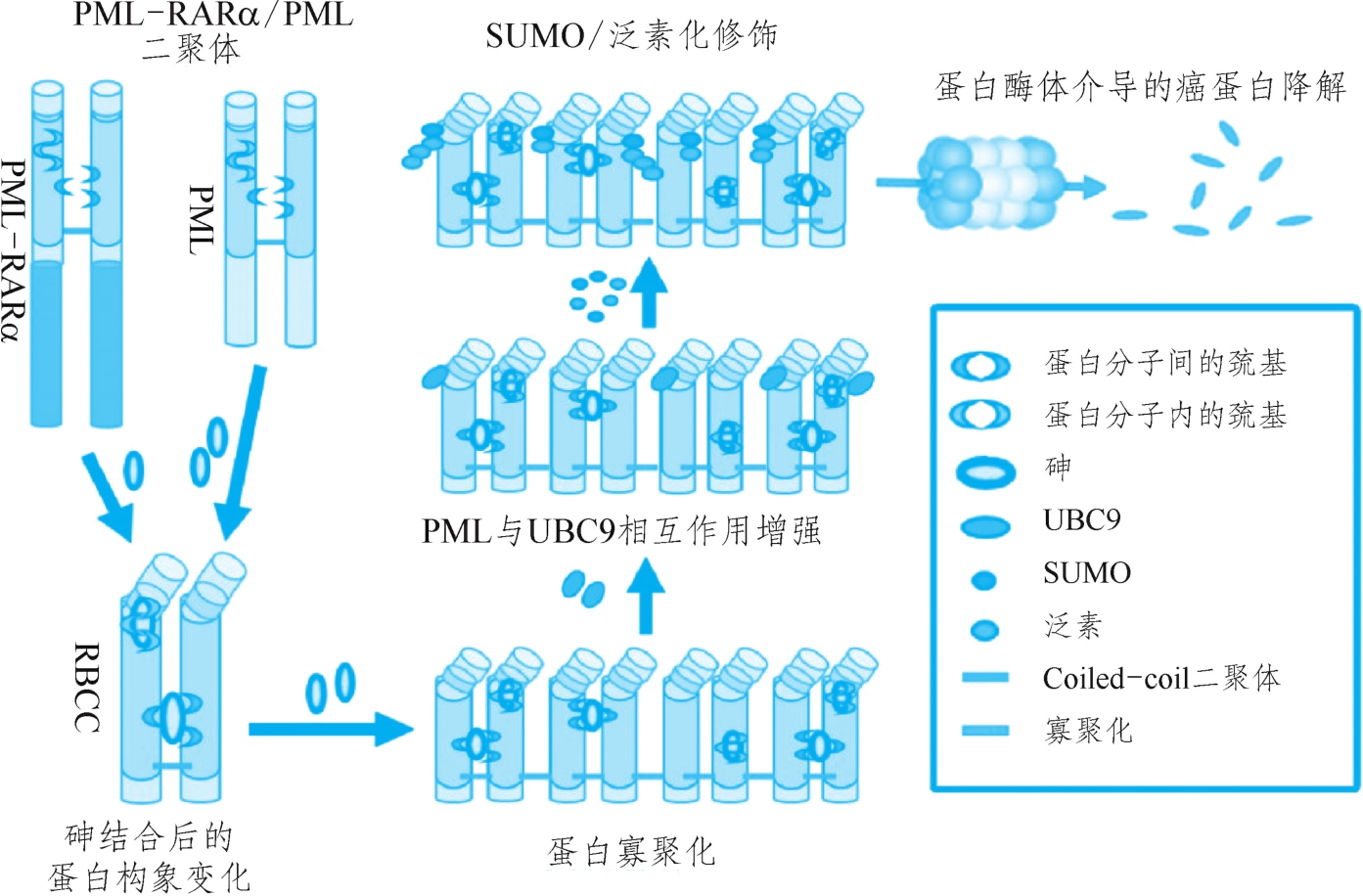
图1-8-2 砷靶向结合PML-RARα癌蛋白RBCC结构域诱导蛋白降解的分子机制示意图
在协同靶向治疗的分子调控网络研究方面,上海血液学研究所应用系统生物学的理念和方法,通过整合基因芯片、二维凝胶电泳及质谱分析等手段,对APL细胞株NB4分别用ATRA、砷剂和ATRA合并砷剂进行处理,在不同的时间点对基因组转录和蛋白质组表达进行高通量、多层面的定量分析,发现了一系列与粒系分化及凋亡相关的分子调控网络的新特点,包括转录因子及辅助转录因子、钙信号通路、干扰素通路、泛素-蛋白酶体系统的激活,PML-RARα蛋白的降解和NB的重建,细胞周期阻滞及凋亡潜能的重新获得等。有意义的是,发现ATRA主要调节细胞分化相关的基因组转录表达,三氧化二砷则主要通过对蛋白质修饰调变发挥作用,两药联合对PML-RARα融合蛋白的降解及分化、凋亡机制激活产生协同作用。
上述研究运用现代科学手段揭示了古老中药砷剂的分子作用机制,阐明了砷剂“以毒攻毒”的药物作用靶点。同时,这些工作还特别揭示了三氧化二砷和ATRA协同治疗APL的分子机制:砷剂和ATRA通过不同的途径靶向同一癌蛋白的两个不同部分而发挥降解致病蛋白、干扰靶基因的转录调控和清除白血病起始细胞的作用(图1-8-3)。因此,APL已成为癌症研究的热点,为肿瘤协同靶向治疗新策略提供了理论和实践依据。
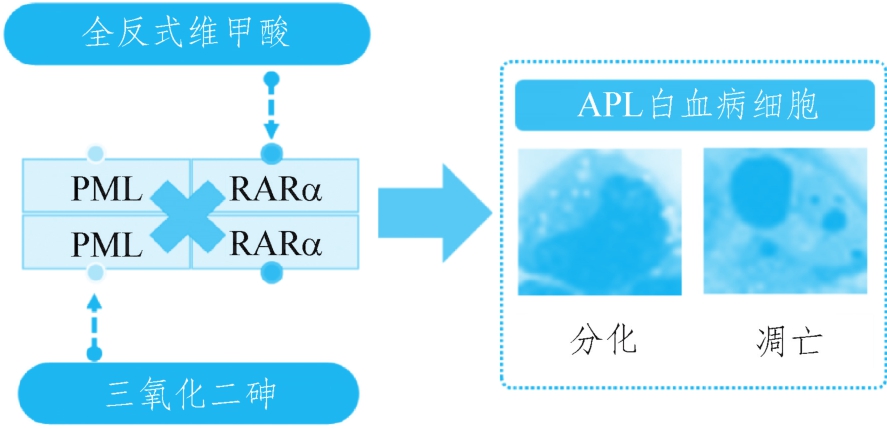
图1-8-3 三氧化二砷和ATRA协同靶向PMLRARα癌蛋白发挥抗白血病作用
