肺与大肠相表里“由肠及肺”路径的研究
1995年,崔乃强等根据重症急腹症和腹部大手术后出现的MODS,采用通里攻下法治疗获得良好的疗效。1998年,赵卫川、崔乃强等观察了肠内压与肠道内毒素转运的关系及中药大承气汤的影响,发现肠道内毒素转运与肠腔内压力有关,大承气汤能够降低肠腔内压力,减少内毒素移位。
(1)阳明腑实证大鼠模型制备 健康雄性Wistar大鼠,采用人工胃液联合大肠杆菌腹腔内注射制备大鼠腹腔感染模型。2小时后分别取菌液按照1.0 m L/100 g体重,左下腹腹腔内注射,制成阳明腑实证模型。假手术组以等量10%BaSO4营养肉汤取代菌液注射。
(2)体内重要器官组织内毒素水平分布 观察主要脏器组织LPS的分布情况。结果表明两组大鼠的肾脏和肺单位组织中内毒素含量较高,其次是肝、脾、胰腺、肠系膜淋巴结、心脏。制模后12 h、24 h和48 h阳明腑实证模型组大鼠内毒素含量居前三位的脏器均为肾、肺、肝,见表1-14-11。
表1-14-11 大鼠阳明腑实证模型制备12h组织I125-LPS的分布情况(kdpm/g)
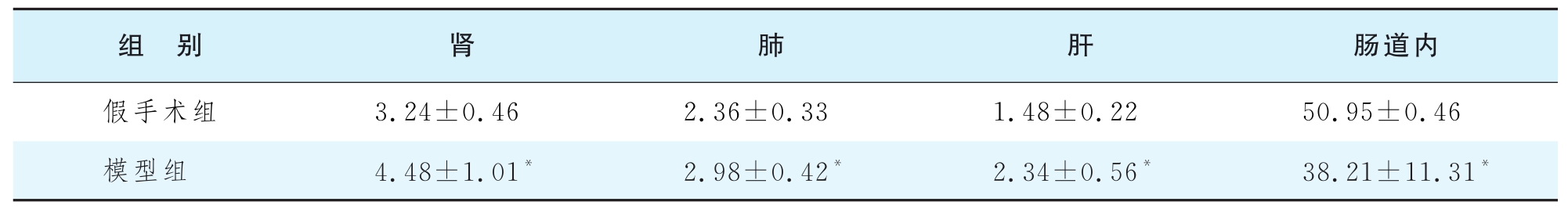
注:与假手术组比较,*P<0.05
(3)阳明腑实证模型大鼠体内液体成分中内毒素含量变化 在脊柱左侧约1cm处打开腹膜,找到腹主动脉。在其左后方乳白色半透明薄壁管道,即为乳糜管腹段。置管引流淋巴液。检测阳明腑实证模型大鼠造模12 h、24 h和48 h股静脉、门静脉、腹主动脉、肝静脉及胸导管淋巴液中内毒素含量。12 h体液中内毒素含量从高到低依次均为尿、胸导管淋巴液、门静脉、股静脉,其中淋巴液内毒素含量约是门静脉的10倍,模型组尿、胸导管淋巴液、门静脉和股静脉的内毒素浓度明显高于假手术组(P<0.05),见表1-14-12。
表1-14-12 大鼠阳明腑实证模型制备12h体内液体中I125-LPS分布情况(kdpm/g)

注:*与假手术组比较,P<0.05,▲胸导管淋巴液与门静脉相比,P<0.01
进一步研究结果:24 h和48h股静脉内毒素含量较12h均明显增加(P<0.05)。提示:① 在阳明腑实证大鼠制模成功后24 h以内,肠源性内毒素“由肠及肺”的途径以淋巴途径为主。此时尽管有相当可观数量的内毒素进入门静脉,但由于肝脏内皮网状吞噬的减毒作用,大量内毒素被“扣押”在肝脏而未经肝静脉、下腔静脉回到右心。此阶段大鼠的死亡率为20%。② 在阳明腑实证大鼠制模成功后24~48 h及以后,肝脏功能受损最重,肝脏内皮网状吞噬的减毒作用饱和,门静脉途径打通,经肝静脉内毒素回心入肺的内毒素增多,肠源性内毒素“由肠及肺”的途径以门静脉途径为主。24 h后门静脉的携带内毒素能力远远高于胸导管淋巴液,大鼠死亡率进一步上升至50%。
(4)阻断腹腔淋巴回流对阳明腑实证大鼠早期肺损伤的影响 健康雄性Wistar大鼠,随机分为假手术(SO)组、阳明腑实证模型(M)组、胸导管结扎(TL)组和胸导管结扎加引流(TLD)组。TL组于制模后2 h,腹正中切口进腹后,找到位于腹主动脉左后方乳白色、半透明状的胸导管腹段,于靠近膈肌处穿线结扎胸导管。TLD组在结扎胸导管后,引流近端淋巴液,持续引流4 h,可获得淋巴液约1.2 m L备用。制模后6 h各组大鼠分别行右主支气管肺泡灌洗,留取BALF行细胞学分析。距回盲部5~10 cm处取末端回肠5 cm,和左下肺叶组织行苏木精-伊红染色观察病理改变。继续取5 cm末端回肠和左肺上叶,检测肺和回肠组织髓过氧化物酶(myeloperoxidase,MPO)活性。
(5)淋巴液回输研究 取阳明腑实证组及假手术组大鼠的淋巴液,再将淋巴液经颈静脉用微量泵以1 m L/h的速度自颈内静脉缓慢输入给健康大鼠。输液结束后,处死大鼠,留取肺组织观察其病理学改变、检测湿重/干质量比值(W/D)、MPO酶活性、肺组织炎症因子水平以评估肺损伤的情况,见表1-14-13。
表1-14-13 大肠腑实证大鼠肺组织W/D与MPO活性(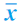 ±s)
±s)

注:*与大肠腑实证回输组比较,P<0.01。
(6)淋巴液回输后肺组织匀浆中TNF-a及IL-6水平 大肠腑实证回输组肺组织匀浆中TNF-a及IL-6水平均显著高于对照回输组,见表1-14-14。
表1-14-14 各组大鼠肺组织TNF-a及IL-6浓度变化( ±s,pg/m L)
±s,pg/m L)
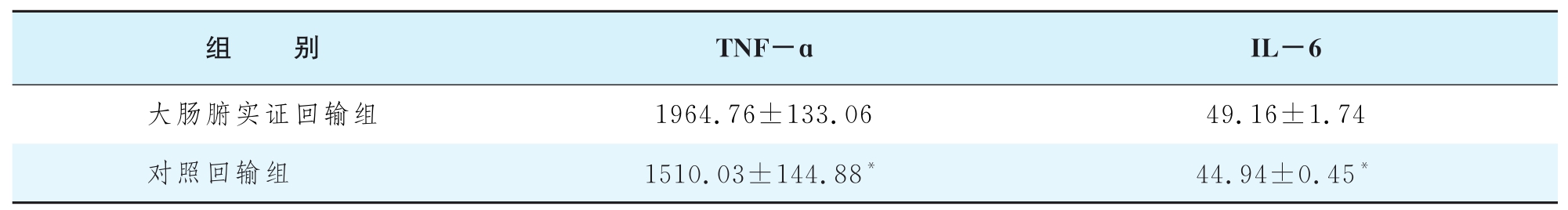
注:*与大肠腑实证回输组比较,P<0.01。
光镜下可见,大肠腑实证淋巴液回输组可见肺损害:肺泡大小不均,完整性破坏,肺泡腔有蛋白样渗出物,肺泡壁增厚,间隔增宽,肺间质和肺泡水肿,大量炎细胞浸润,微血管和肺间质可见充血及出血。假手术组淋巴液回输后肺泡大小均匀,结构完整,壁薄,未见出血、水肿及炎性细胞浸润。
(7)支气管灌洗和BALF分析 造模后,处死大鼠,解剖游离出右主支气管,插入硅胶管,用2 m L生理盐水行肺泡灌洗2次,滞留5 min后缓慢吸出。将两次BALF放入同一离心管中,1500 r/min离心10min,回收上清液,按试剂盒说明,考马斯亮兰法检测BALF中蛋白含量,ELISA检测TNF-α含量。用1 m L生理盐水重悬细胞沉淀,取30μL重悬液涂片,进行细胞分类计数。
大肠腑实证模型组BALF蛋白和TNF-α含量均高于SO组(P<0.05),TL组和TLD组蛋白和TNF-α含量均较腹腔内感染(IAI)组降低(均P<0.05),见表1-14-15。
综上研究提示,在阳明腑实证时肠道细菌内毒素进入肠道淋巴系统,并经肠淋巴管进入肺脏,导致肺支气管、肺泡中性粒细胞大量聚集,继而产生大量细胞因子,并由此启动一系列炎症反应。同时淋巴液中一些酶类水平也明显升高。部分揭示了肠淋巴途径是阳明腑实证、肺与大肠相表里由肠及肺的早期途径。
表1-14-15 各组大鼠BALF蛋白和TNF-α含量变化(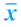 ±s)
±s)
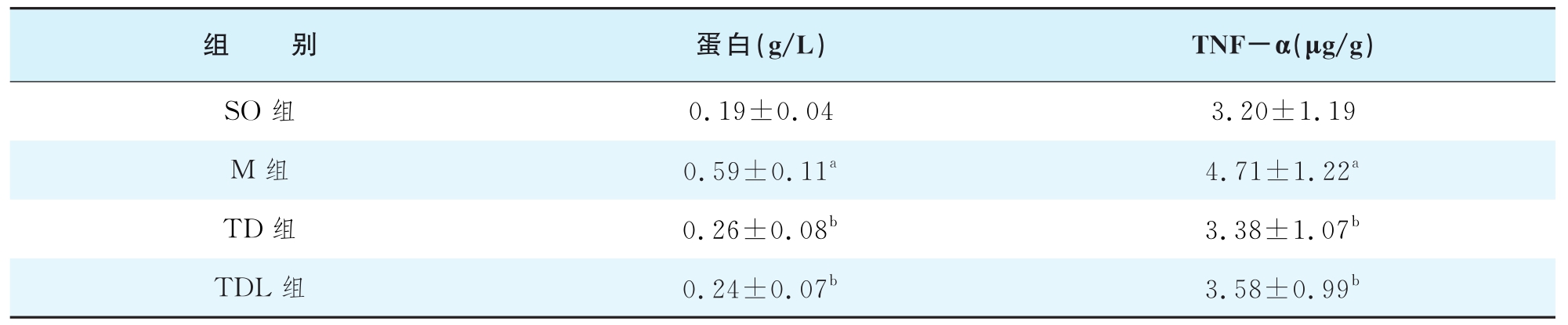
注:a与SO组比较,P<0.05;b与M组比较,P<0.05
