二氯化镭[223Ra](Radium Ra 223 Dichloride)
【商品名】
二氯化镭[223Ra]。
【药理】
1.药效学
本药活性成分为可发射α粒子的放射性核素镭-223。镭-223模拟钙离子在骨转换增强部位(如骨转移部位)与骨盐羟磷灰石形成复合物,发射的α粒子具有高传能线密度,可导致邻近细胞DNA双链高频断裂,从而发挥抗骨转移肿瘤的作用。本药发射的α粒子小于100μm(<10个细胞直径),故对周围正常组织的损伤有限。
2.药动学
本药药动学在46~250kBq/kg的剂量范围内与剂量成比例,与时间无关。静脉注射后镭-223迅速从血液清除,主要分布至骨或肠。静注后15分钟,停留在血液中的放射活性约20%,4小时后约4%,24小时后减少至低于1%。注射后10分钟,骨和肠道内可观察到放射活性。注射后4小时,骨和肠道内放射活性剂量比分别为61%和49%,其他器官(如心脏、肝脏、肾脏、膀胱、脾脏)未见显著摄取。本药可衰变但不经代谢。静注后7日,约63%放射活性排出体外。静注后48小时随粪便排泄的总量为13%(0%~34%),随尿液排泄的总量为2%(1%~5%)。随粪便排泄为主要排泄途径,小肠转运速率对胃肠道排泄速率影响较大。本药不随胆汁排泄。
本药在各器官的辐射吸收剂量表
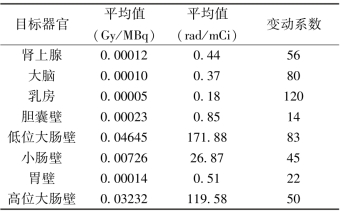
续表
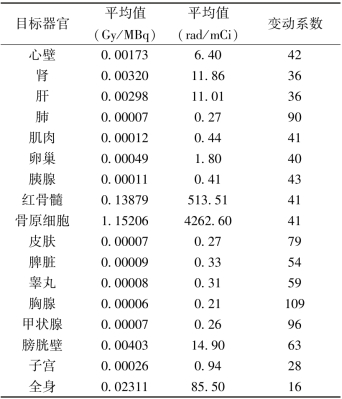
【临床应用】
用于治疗有骨转移症状但无内脏转移的去势抵抗性前列腺癌(FDA批准适应证)。
【用法与用量】
成人
·去势抵抗性前列腺癌
·静脉注射 一次50kBq/kg(1.35μCi/kg),每4周1次,共给6次。给药体积按下式计算:给药体积(ml)=[体重(kg)×50kBq/kg]/(衰变因子×1000kBq/ml),或给药体积(ml)=[体重(kg)×1.35μCi/kg]/(衰变因子×27μCi/ml)。衰变因子如下表:
衰变校正因子表

续表
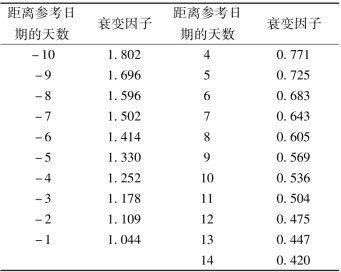
注:①上表依据美国中部标准时间(CST)正午12点制订。②参考日期见包装。
·肾功能不全时剂量
轻度[肌酐清除率(Ccr)为60~89ml/min]至中度(Ccr为30~59ml/min)肾功能损害者无须调整剂量。尚无重度(Ccr<30ml/min)肾功能损害者剂量调整方案。
·肝功能不全时剂量
轻度肝功能损害者无须调整剂量。尚无中至重度肝功能损害者剂量调整方案。
·老年人剂量
老人用药无须调整剂量。
【不良反应】(https://www.daowen.com)
1.泌尿生殖系统
可见肾衰竭、肾损害。
2.胃肠道
常见恶心、腹泻、呕吐。
3.血液
可见贫血、淋巴细胞减少、白细胞减少、血小板减少、中性粒细胞减少、骨髓衰竭、全血细胞减少。
4.其他
常见外周水肿。可见脱水、继发性恶性肿瘤(包括骨肉瘤)。有注射部位出现红斑、疼痛、水肿的报道。
【注意事项】
1.用药警示
①给药前后应迅速使用适当的放射性核素剂量校准仪测定患者接受本药的净含量。②首次给药前患者中性粒细胞绝对计数(ANC)应大于或等于1.5×109/L,血小板计数应大于或等于100×109/L,血红蛋白应大于或等于10g/dl。之后每次给药前患者ANC应大于或等于1×109/L,血小板计数应大于或等于50×109/L。③如最近一次给药后6~8周内患者ANC及血小板计数未恢复,即使接受支持治疗,也不得再使用本药。④如给予其他放射性核素或伴有体外辐射治疗时,应停用本药。⑤本药可能影响精子生成,故用药期间及停药后6个月内性活跃男性应使用避孕套,且其具有生育能力的伴侣应采取高效避孕措施。⑥本药如接触皮肤或眼睛,应立即用水冲洗。
2.禁忌证
妊娠期妇女及可能妊娠的妇女(国外资料)。
3.慎用
尚不明确。
4.不良反应的处理方法
①如出现骨髓储备减少,应给予患者支持治疗。给予支持治疗后仍出现危及生命的并发症的患者应停药。②如出现脱水或血容量减少的症状和体征,应立即给予治疗。
5.用药前后及用药时应当检查或监测
①首次给药及每次给药前均应检查血常规。②密切监测患者液体摄入量及体液状态。
6.其他注意事项
本药可能通过患者体液(如尿液、粪便、呕吐物)对其他人员(如医务人员、看护人、患者家庭成员)产生辐射污染,故以上人员应采取辐射防护。
7.特殊人群
(1)儿童:18岁以下儿童用药的安全性和有效性尚不明确。
(2)老人:尚未观察到老人用药安全性和有效性与年轻患者的差异,但不排除部分老人对本药更敏感。
(3)妊娠期妇女:①妊娠期妇女用药可导致胎儿损害,故妊娠期妇女及可能妊娠的妇女禁用。有生育能力的妇女用药期间应避免妊娠。②美国食品药品管理局(FDA)对本药的妊娠安全性分级为X级。
(4)哺乳期妇女:本药是否随人类乳汁排泄尚不明确,哺乳期妇女应停药或用药时停止哺乳。
【制剂与规格】
二氯化镭[223 Ra]注射液 6ml:6000kBq(162μCi)。
贮法:置原有容器或辐射防护容器内室温(低于40℃)保存。
